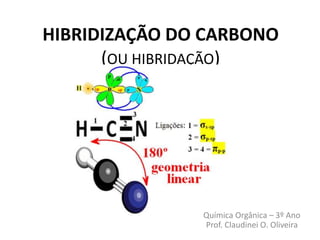
O documento discute a hibridização do carbono, que permite ao átomo formar um número maior de ligações aumentando sua estabilidade. Existem três tipos de hibridização para o carbono: sp3, onde o carbono forma quatro ligações tetraédricas; sp2, onde forma três ligações sigma trigonais planas e uma ligação pi; e sp, onde forma duas ligações sigma e duas ligações pi em geometria linear.