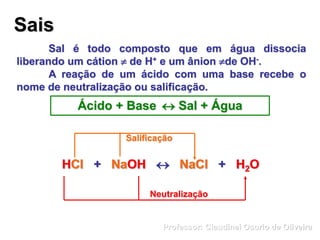
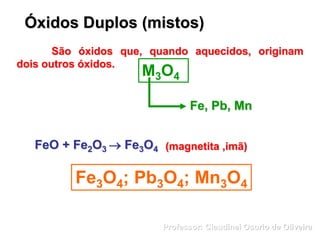
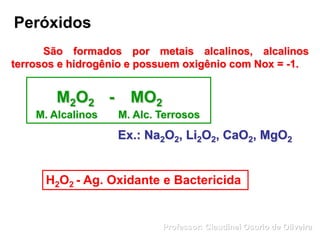
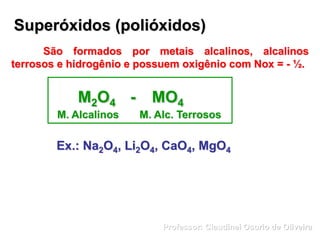
O documento discute sais e óxidos, definindo-os como compostos iônicos formados pela neutralização de ácidos e bases ou pela combinação de elementos com oxigênio, respectivamente. Ele também aborda suas nomenclaturas, classificações, propriedades e usos de alguns sais e óxidos importantes como o bicarbonato de sódio, o óxido de zinco e a magnetita.