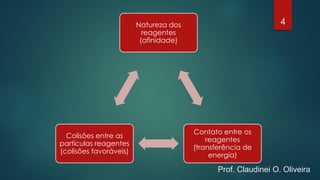
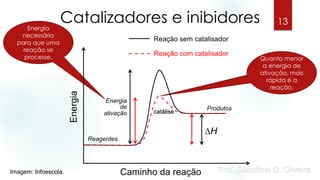
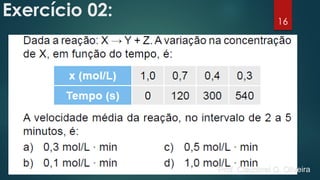
O documento discute os fatores que influenciam a velocidade das reações químicas, incluindo a natureza dos reagentes, a área de superfície de contato, a temperatura, a concentração e pressão, e catalisadores e inibidores. Exemplos são fornecidos para ilustrar como esses fatores afetam a velocidade da reação.