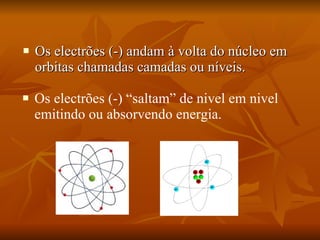
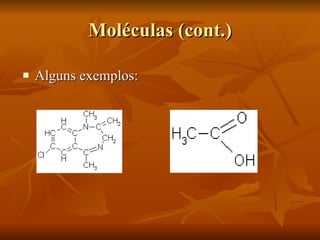
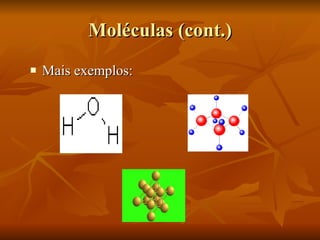
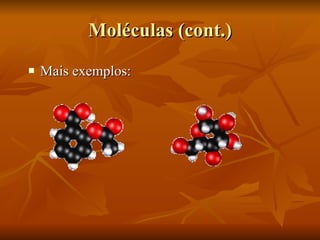
O documento descreve a história da compreensão do átomo, começando com Demócrito na Grécia antiga que propôs a ideia de átomos indestrutíveis. Ao longo dos séculos, vários modelos atômicos foram desenvolvidos, incluindo as esferas de Dalton, o modelo de "pudim de passas" de Thomson, o modelo planetário de Rutherford e as órbitas elípticas de Bohr. O modelo atômico moderno envolve uma nuvem de probabilidade ao invés de órbitas definidas. O