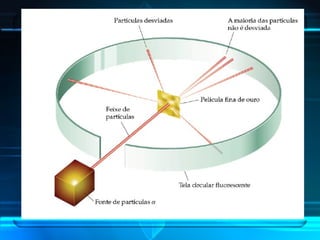
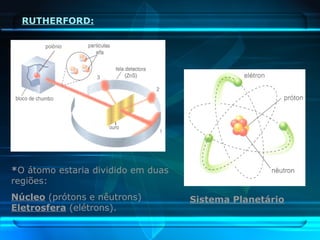
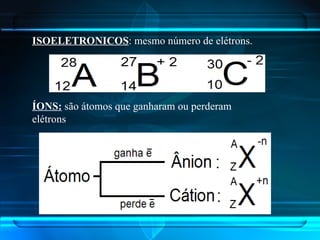
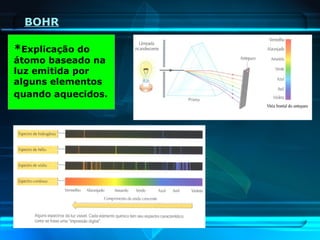
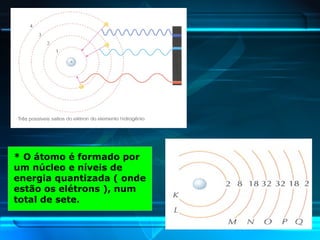
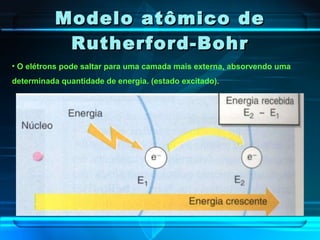
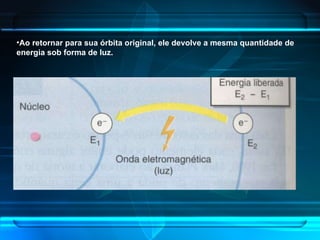
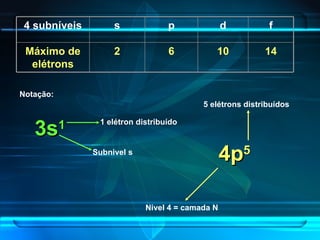
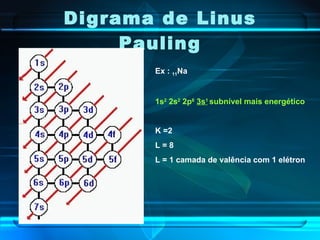
O documento descreve a evolução do modelo atômico ao longo da história, desde Demócrito na Grécia antiga até o modelo atômico de Rutherford-Bohr. Inclui conceitos como número atômico, massa atômica, isótopos, íons e a estrutura atômica com níveis de energia quantizada onde os elétrons orbitam o núcleo.