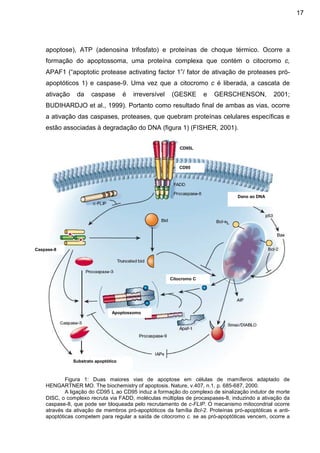
Este documento descreve uma monografia sobre os mecanismos de indução da apoptose por glicocorticóides e seus efeitos no câncer. A monografia foi apresentada por Leda Marília Fonseca Lucinda como parte dos requisitos para obtenção do título de Especialista em Parasitologia, Microbiologia e Imunologia pela Universidade Federal de Juiz de Fora em 2009.