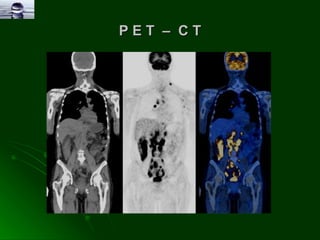
O documento discute como a radiobiologia clínica está evoluindo para um tratamento mais personalizado do câncer através do uso de terapias moleculares direcionadas, inibidores da angiogénese e dos proteosomas, imunoterapia, e imagiologia molecular para melhor caracterizar os tumores. Novas estratégias como drogas bioredutoras e simulações computacionais também estão sendo desenvolvidas para otimizar o tratamento com radiação.










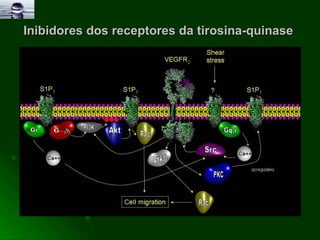
![Inibidores dos receptores da tirosina-quinase O crescimento celular nos tecidos normais é controlado pelo equilíbrio entre factores promotores e inibidores do crescimento Quando este equilíbrio é perturbado as células podem crescer descontroladamente (cancro) Um dos factores chave do crescimento celular é a dupla: Factor de Crescimento Epidérmico [(EGF) epidermal growth factor] Receptor do EGF na membrana celular [(EGFR) EGF receptor](https://image.slidesharecdn.com/radiobiologia1-091218071456-phpapp02/85/Radiobiologia-13-320.jpg)




![Inibidores da angiogénese As células neoplásicas segregam para os tecidos circundantes moléculas estimuladoras de crescimento vascular: Factor de Crescimento do Endotélio Vascular [vascular endothelial growth factor (VEGF)] Factor de Básico de Crescimento dos Fibroblastos [basic fibroblast growth factor (bFGF)] A ligação do factor de crescimento a um receptor de parede activa a via de sinalização intracelular -> formação de células endoteliais As células endoteliais activadas produzem enzimas capazes de degradar a matriz extracelular dos tecidos circundantes. Isto permite às células endoteliais migrar, dividirem-se e organizarem-se para formar uma nova rede vascular.](https://image.slidesharecdn.com/radiobiologia1-091218071456-phpapp02/85/Radiobiologia-19-320.jpg)