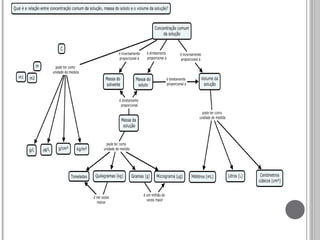
O documento explica o que é concentração comum, definindo soluto e solvente e mostrando como a concentração é calculada usando a massa do soluto e o volume da solução. Exemplos incluem a concentração de carboidratos no leite e de NaCl no sangue humano, calculando a massa total de cada soluto. A conclusão é que a concentração se refere à relação entre a massa do soluto dissolvido e o volume total da solução.



![A QUANTIDADE DE SOLUTO E DADA
POR SUA CONCENTRAÇÃO.
Porcentagem em massa (%) massa de solução
massa da solução
Concentração comum (C) massa do soluto
volume da solução
Molaridade (M) mol de soluto
volume da solução em L
Concentração molar (M) = [...]](https://image.slidesharecdn.com/somosfsicos1-161013223329/85/Somos-Fisicos-Concentracao-Comum-4-320.jpg)