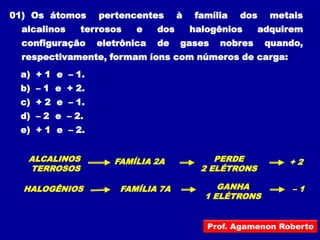
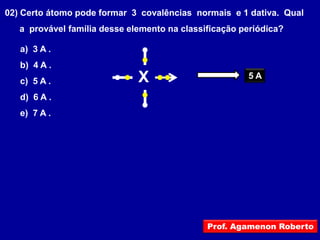
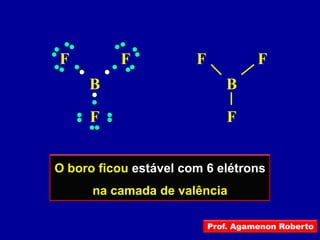
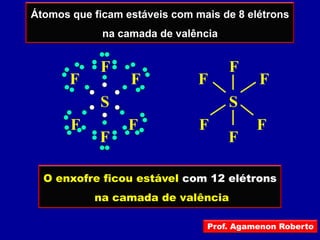
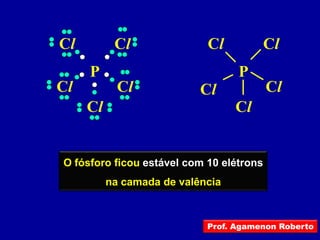
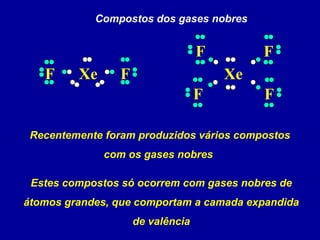
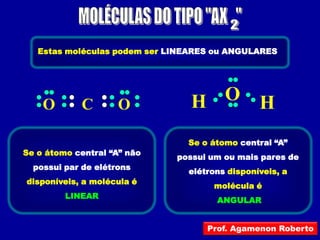
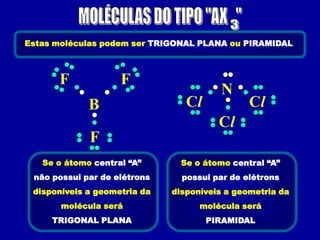
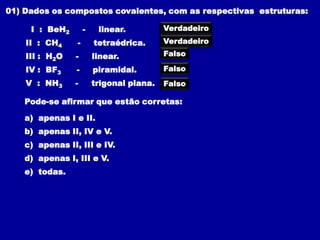
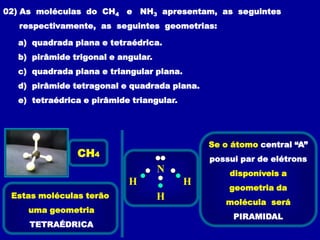
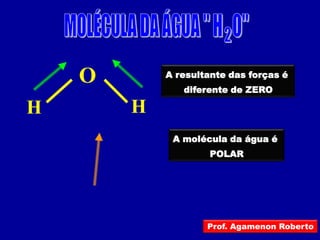
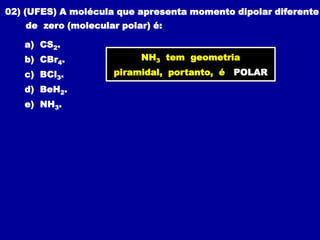
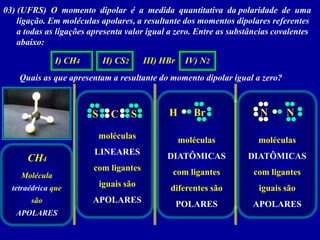
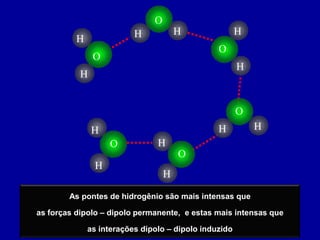
Este documento discute os conceitos de ligação química, incluindo:
1) Ligação química ocorre quando átomos compartilham ou transferem elétrons para formar ligações estáveis.
2) Há três tipos principais de ligação: iônica, covalente e covalente dativa. Ligação iônica envolve transferência de elétrons; covalente envolve compartilhamento de elétrons; covalente dativa envolve um átomo cedendo elétrons.
3) A