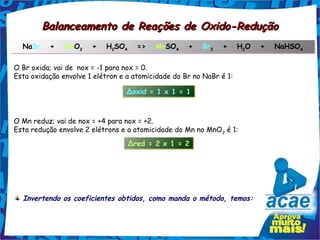
O documento descreve três tipos de reações químicas: 1) Reações de síntese e análise, onde novas substâncias são formadas a partir de outras; 2) Reações de deslocamento ou troca simples, onde um elemento desloca outro de uma substância composta; 3) Reações de substituição ou dupla troca, onde duas novas substâncias compostas são formadas a partir de outras duas existentes.