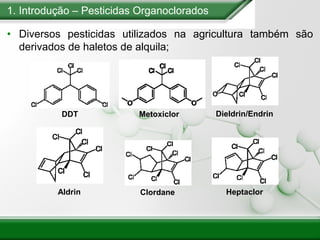
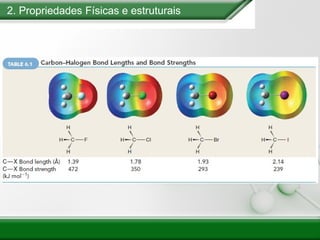
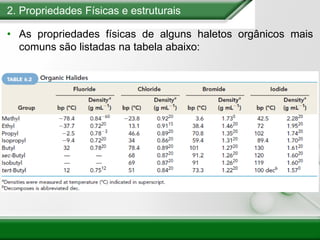
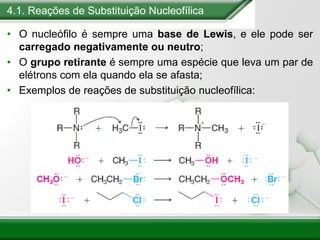
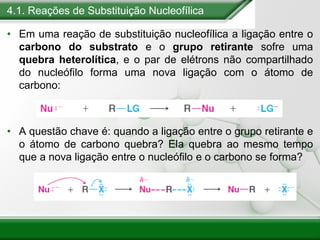
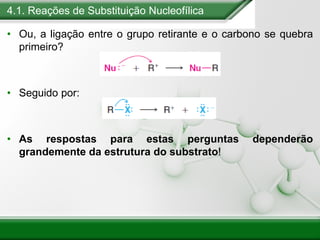
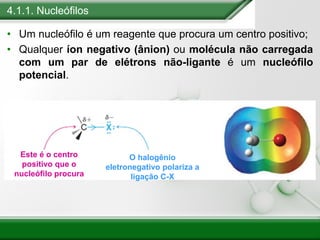
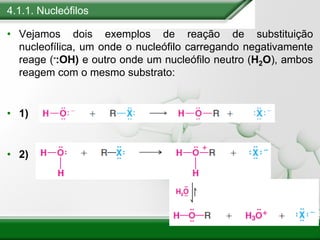
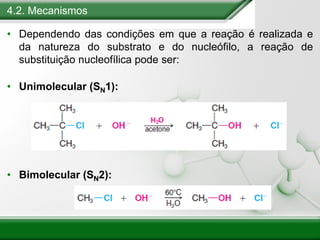
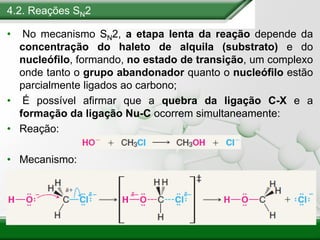
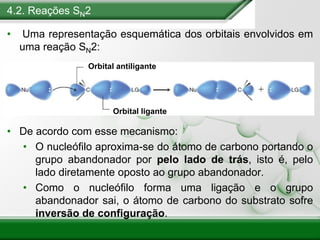
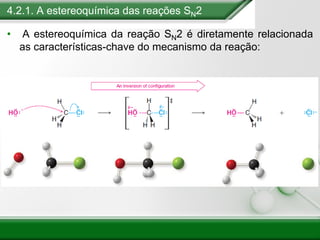
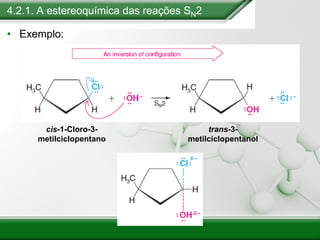
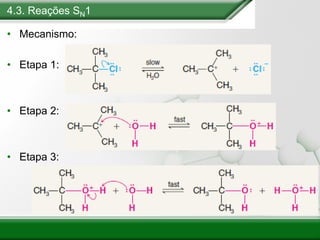
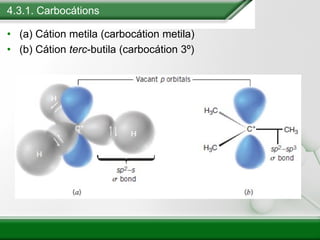
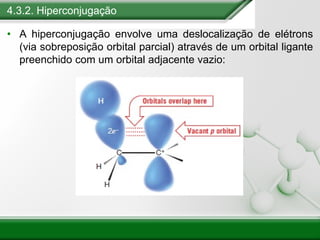
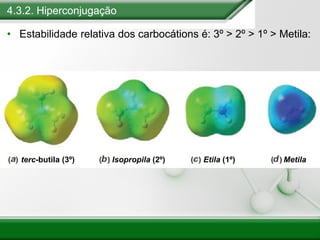
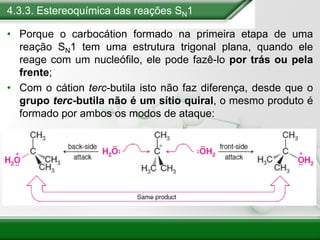
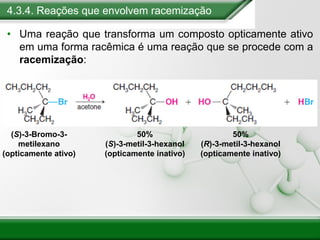
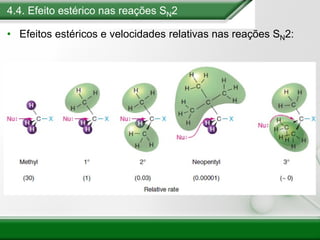
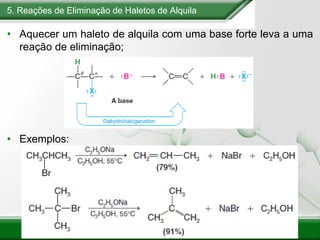
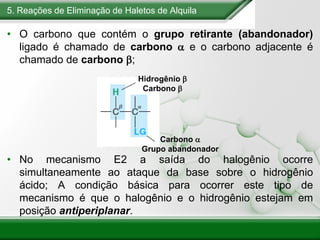
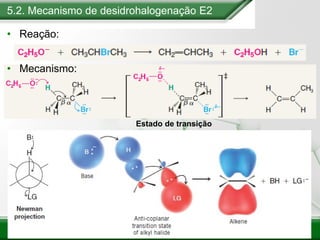
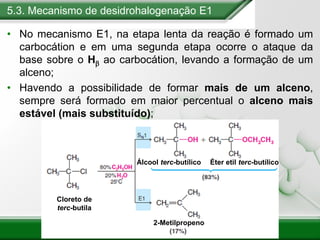
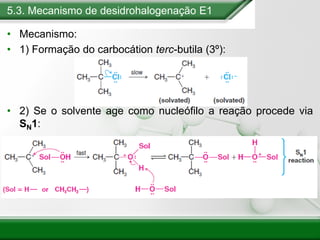
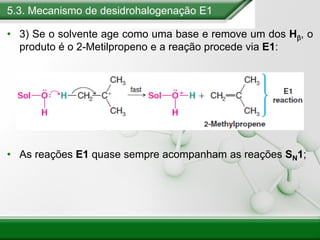
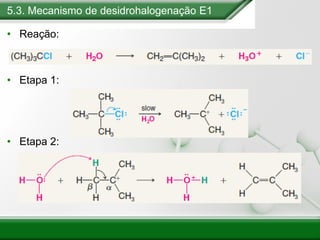
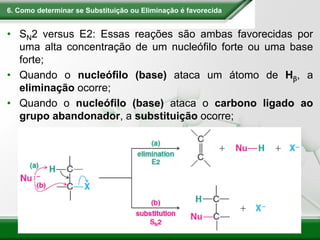
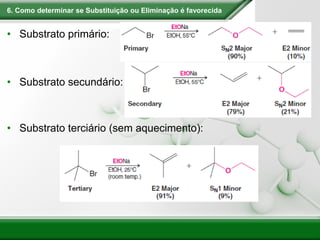
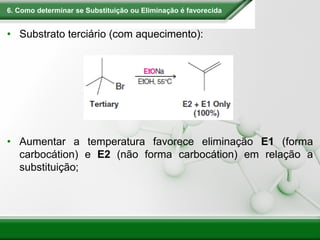
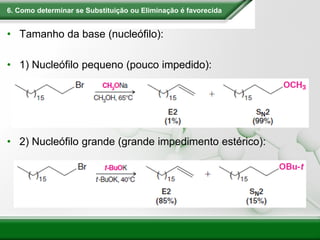
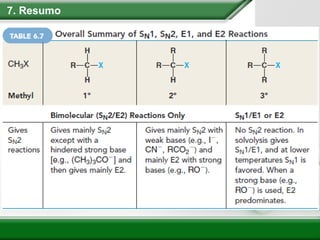
[1] Os haletos de alquila são compostos importantes industrialmente e no cotidiano, sendo usados como solventes, refrigerantes e pesticidas. [2] Esses compostos podem sofrer reações de substituição nucleofílica e eliminação. [3] O mecanismo e estereoquímica dessas reações dependem da estrutura do substrato e dos nucleófilos envolvidos.