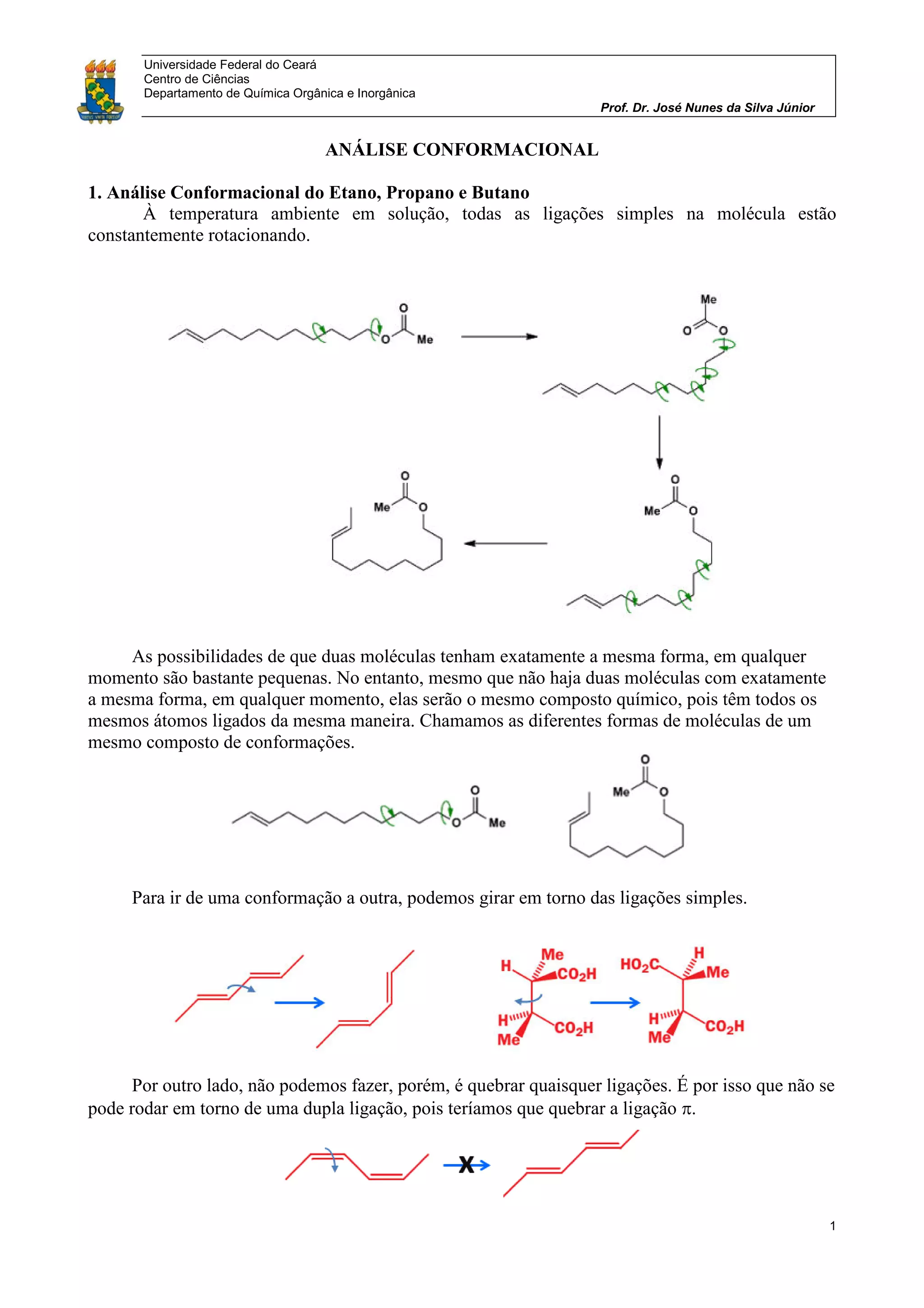
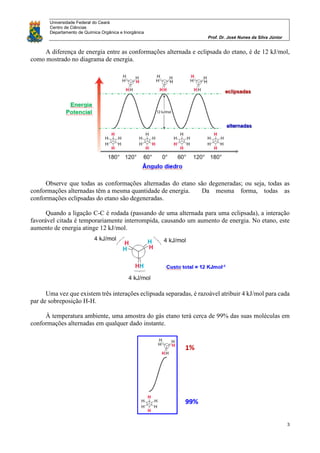
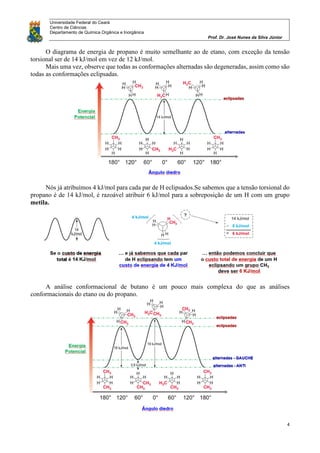
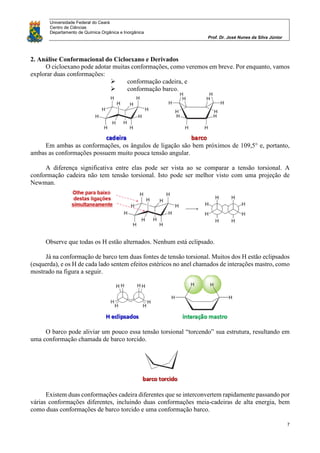
O documento discute análise conformacional de moléculas orgânicas como etano, propano, butano e cicloexano. Analisa as diferentes conformações possíveis dessas moléculas e as diferenças de energia entre conformações alternadas e eclipsadas. Explica como a posição dos substituintes em cicloexanos monossubstituídos leva a duas conformações distintas em equilíbrio.