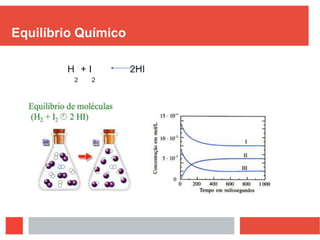
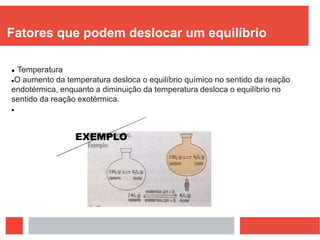
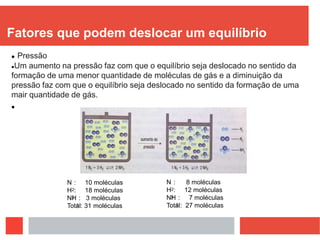
Este documento discute equilíbrio químico, definindo-o como uma situação em que a proporção entre reagentes e produtos permanece constante ao longo do tempo. Explica que para o equilíbrio ocorrer, a reação deve ser reversível e ocorrer em sistema fechado, e que quando perturbado o sistema se desloca para anular a perturbação. Fatores como temperatura, pressão e concentração podem deslocar o equilíbrio.