Incorporar apresentação
Baixar para ler offline



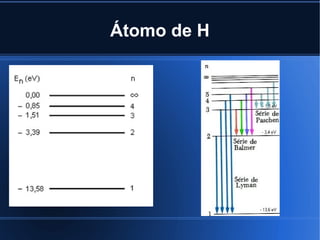





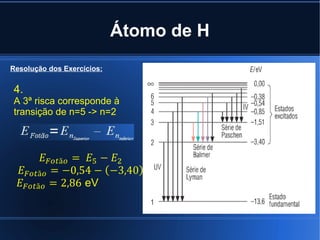


Niels Bohr propôs em 1913 uma teoria atômica que explicava os espectros de emissão de riscas, admitindo que os eletrões podem ocupar apenas certos níveis de energia nos átomos e que transições entre esses níveis explicam a absorção e emissão de energia como radiação eletromagnética.











