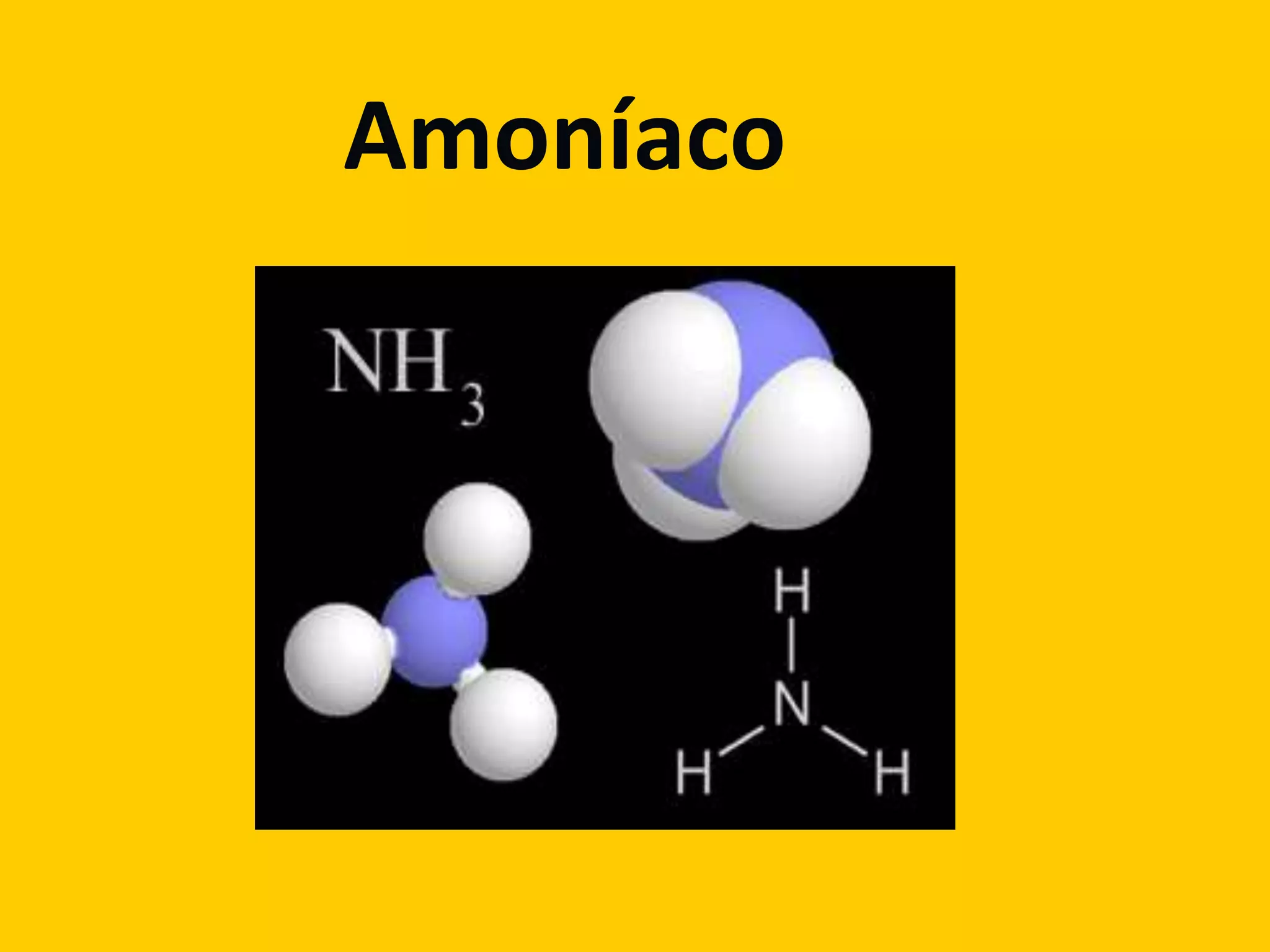
O documento descreve as propriedades e aplicações do amônia (NH3), incluindo sua fórmula, ponto de fusão, efeitos na saúde e meio ambiente. Produz-se industrialmente através do processo Haber-Bosch, onde o nitrogênio e o hidrogênio reagem a altas pressões e temperaturas na presença de um catalisador de ferro.