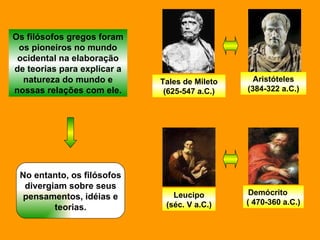
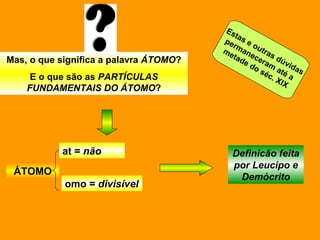
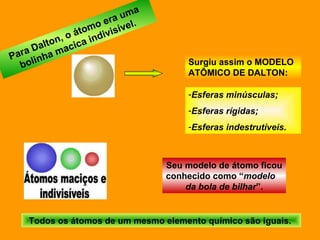
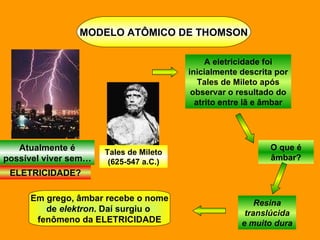
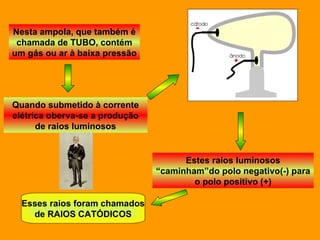
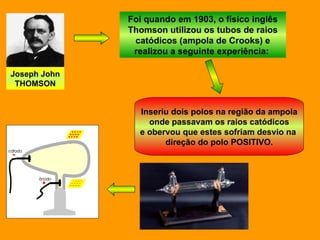
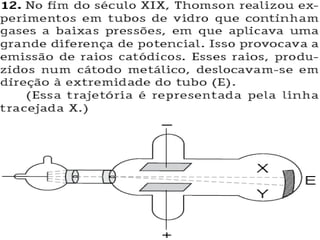
O documento discute os modelos atômicos de Dalton e Thomson. Dalton propôs que os átomos eram esferas minúsculas, rígidas e indivisíveis. Thomson descobriu os elétrons através de experimentos com raios catódicos e propôs um modelo no qual os átomos eram esferas positivas com elétrons embebidos.