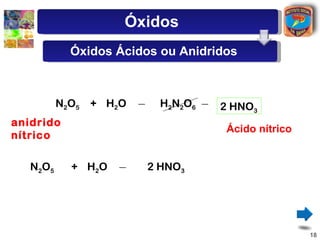
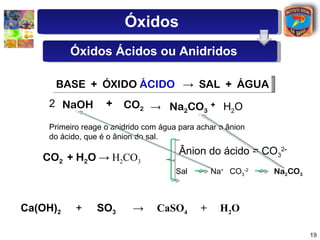
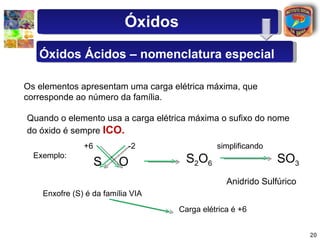
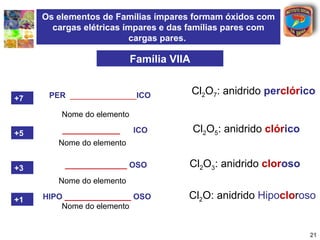
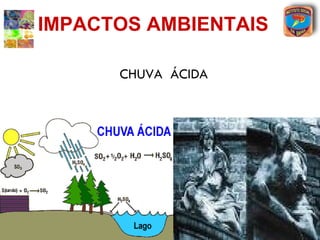
[1] O documento discute os principais tipos de óxidos, incluindo suas definições, nomenclaturas e reações.
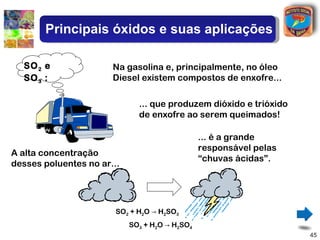
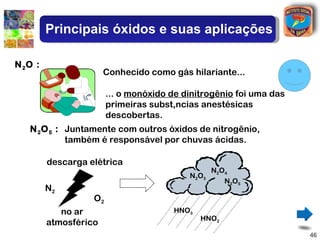
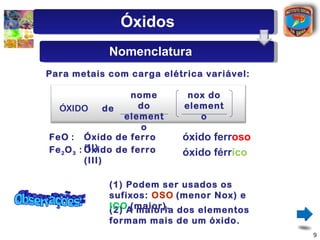
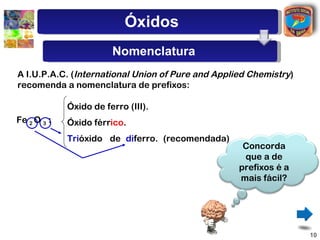
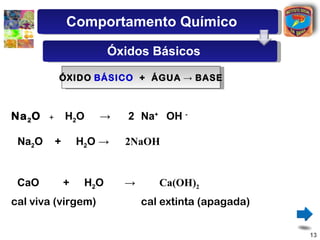
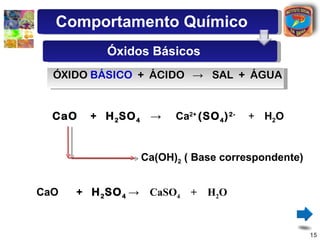
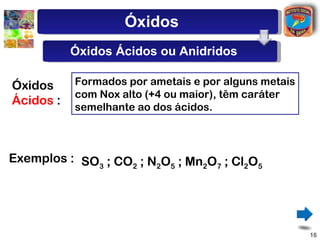
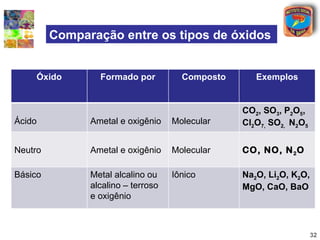
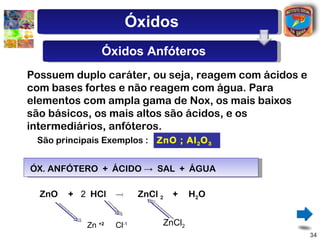
[2] São descritos óxidos básicos, ácidos, neutros e anfóteros, com ênfase nas reações típicas de cada um com água e ácidos/bases.
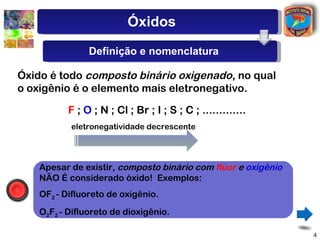
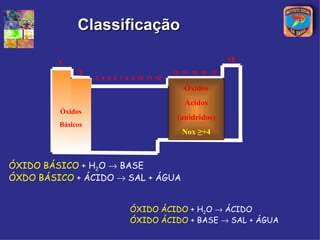
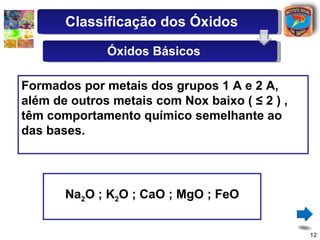
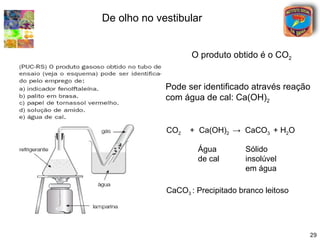
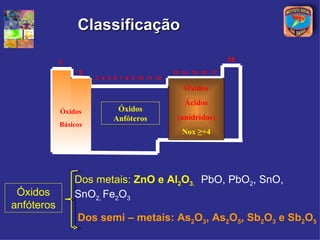
[3] A classificação dos óxidos é apresentada com base na eletronegatividade dos elementos e na carga dos íons formados.

















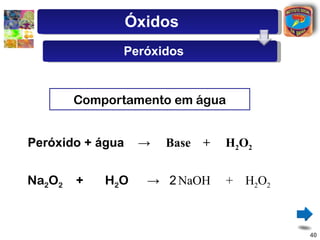
![Óxidos
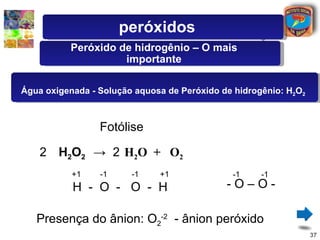
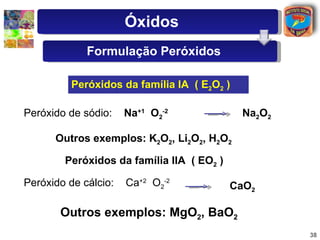
Peróxidos
Formados principalmente por elementos
dos grupos 1 A e 2 A, têm caráter básico.
Devido a uma ligação especial [ - O - O - ],
o oxigênio tem Nox = - 1.
Exemplos : H 2 O 2 ; Na 2 O 2 ; K 2 O 2 ;
CaO 2
39](https://image.slidesharecdn.com/aulasobrexidos-120408201635-phpapp02/85/Aula-sobre-oxidos-39-320.jpg)