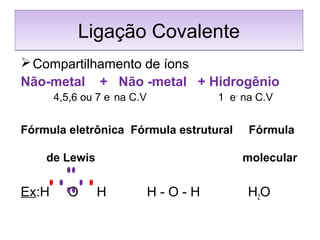
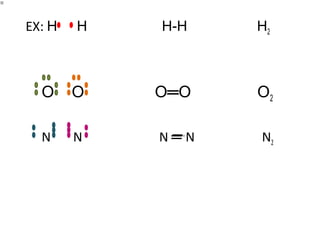
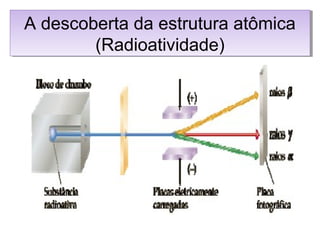
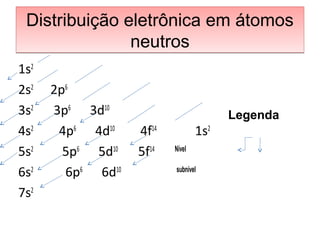
O documento apresenta os principais conceitos da teoria estrutural da química orgânica, incluindo a evolução do modelo atômico desde os gregos antigos até a mecânica quântica. Aborda os modelos de Thomson, Rutherford e Bohr, além de conceitos como número atômico, de massa, distribuição eletrônica e tipos de ligações químicas.












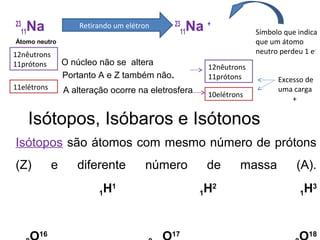









![• Na+
• Na0
O
Íons formados Fórmula do composto
2 [Na]+
[O]2-
Na2O
Regra Prática
Cc+
Aa-
CaAc](https://image.slidesharecdn.com/aula1unice1-150426114923-conversion-gate02/85/Quimica-organica-30-320.jpg)