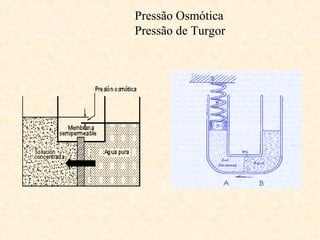
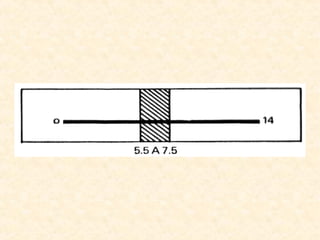
O documento discute várias propriedades fundamentais da água, incluindo sua capacidade de dissolução de compostos, classificação de acordo com teor de sais, oxigênio dissolvido, temperatura, pH, pressão osmótica e tensão superficial. Essas propriedades determinam a distribuição de espécies aquáticas e a qualidade da água.