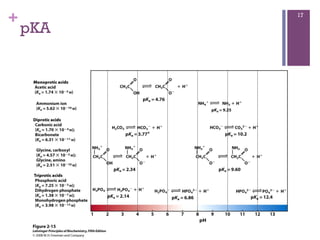
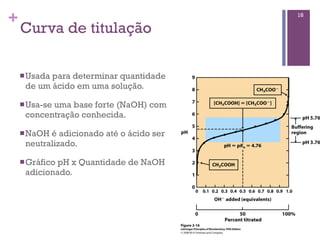
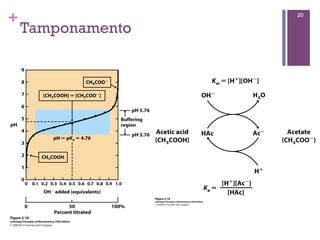
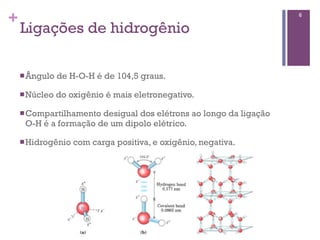
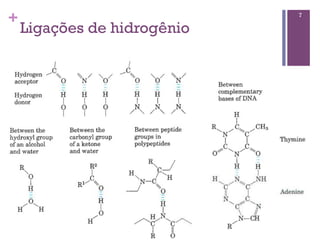
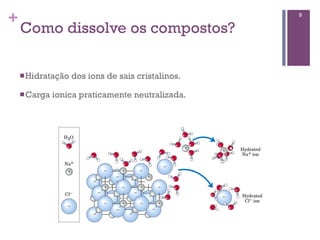
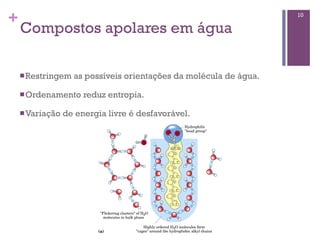
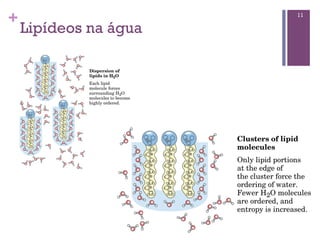
Este documento discute propriedades da água, incluindo sua estrutura molecular, ligações de hidrogênio e capacidade de dissolver outros compostos. Também aborda conceitos como pH, ácidos e bases fracas, tamponamento e a importância destes processos para sistemas biológicos.








![+ 15
Escala de pH
n pH = log 1/[H+] = -log [H+]
n Escala LOGARÍTMICA!](https://image.slidesharecdn.com/gabriel-bioquimica-aula2-130317200251-phpapp02/85/Bioquimica-Aula-2-15-320.jpg)