O documento discute os conceitos de equilíbrio químico, incluindo que as reações raramente são completas e atingem um estado de equilíbrio quando as velocidades das reações em ambas as direções são iguais. A constante de equilíbrio descreve a relação entre as concentrações de reagentes e produtos no equilíbrio e depende da estequiometria da reação. A energia livre de Gibbs e as variações de entalpia e entropia determinam a espontaneidade e direção das re

![http://professorbomfim.no.comunidades.net/index.php
TELEFONE: (21)8507-8891
vf = kf [A]a [B]b
CONC. MOLAR
Onde vf é a velocidade da reação direta, e kf é a constante de velocidade da reação
e depende de fatores tais como temperatura, a presença de um catalisador, etc.
Analogamente, para a reação oposta, Gulberg e Waage escreveram
vb = kb [C]c [D]d
e para o sistema em equilíbrio:
vf = vb
kf [A]a [B] b = kb [C]c [D]d
kf
[C]c [D]d
=
= K eq
kb
[ A ]a [B] b
Esta expressão é uma representação correta da constante de equilíbrio, mas
o método para sua obtenção não tem validade geral. Isto é assim porque as
velocidades de reação na realidade DEPENDEM DO MECANISMO da reação,
determinado pelo número de espécies colidindo, enquanto que a expressão de Keq
depende só da ESTEQUIOMETRIA DA REAÇÃO QUÍMICA.
A única base teórica sólida para a constante de equilíbrio provém de argumentos
termodinâmicos. Ver energia livre de Gibbs mais para frente para o cálculo
termodinâmico dos valores de Keq.
Keq pode ser avaliada empiricamente medindo as concentrações de A, B, C e
D no equilíbrio. Notar que quanto mais favorável a constante de velocidade é para a
reação direta em relação à reação oposta (inversa), maior será a Keq e, no equilíbrio,
mais deslocada para a direita essa reação estará.
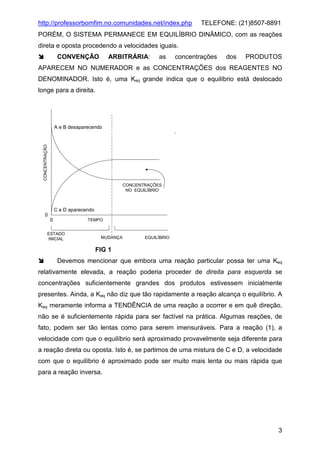
Quando se inicia a reação entre A e B, a velocidade da reação direta será grande
devido a que a concentração de A e B é grande, enquanto a reação inversa é lenta
já que a concentração de C e D é pequena (inicialmente é zero). Conforme a reação
progride, a concentração de A e B diminui e a de C e D aumenta, de forma que a
velocidade da reação direta (para a direita) diminui enquanto aquela para a reação
inversa aumenta Fig 1. Eventualmente, as duas velocidades se igualam e o sistema
alcança o ESTADO DE EQUILÍBRIO. Nesse ponto, as concentrações individuais de
A, B, C, e D permanecem CONSTANTES (os valores relativos dependerão da
estequiometria da reação e de quão deslocado o equilíbrio fica para a direita),
2](https://image.slidesharecdn.com/equilbrio-qumico-131222083302-phpapp02/85/Equilibrio-quimico-2-320.jpg)


![http://professorbomfim.no.comunidades.net/index.php
TELEFONE: (21)8507-8891
O ESTADO DE EQUILÍBRIO.
Consideremos o equilíbrio químico
H3AsO4 + 3 I– + 2H+
↔
H3AsO3 + I3– + H2O
Colorido
A velocidade desta reação e a extensão com que procede para a direita podem ser
rapidamente avaliadas observando a cor amarela-violeta do íon tri-iodeto, I3–, JÁ
QUE O RESTO DOS COMPOSTOS É INCOLOR. Por exemplo, se 1 mmol de
H3AsO4 se acrescenta a 100 mL de uma solução que contém 3 mmol de KI, a cor do
I3– aparecerá quase imediatamente e em poucos segundos a intensidade da cor se
–
fará constante, i.e., [I3 ] = Constante. Uma solução idêntica poderia ser
preparada adicionando 1 mmol de H3AsO3 a 100 mL de solução que contém 1 mmol
de I3–. Agora, a intensidade da cor inicial é maior que a da primeira solução, mas
rapidamente diminui devido à reação
H3AsO3 + I3– + H2O
↔
H3AsO4 + 3 I– + 2H+
Finalmente, a cor de AMBAS SOLUÇÕES É IDÊNTICA.
O exemplo anterior mostra que a relação de concentrações no equilíbrio químico
(i.e., a posição do equilíbrio) é INDEPENDENTE da rota pelo qual o estado de
equilíbrio é alcançado. Além disso, um sistema em equilíbrio NÃO SAIRÁ
espontaneamente dessa condição a menos que uma TENSÃO seja aplicada ao
sistema. Tal tensão inclui
Mudança de Temperatura
ii)
ou produtos é um gás); ou
i)
Mudança de Pressão (se um dos reagentes
iii)
Na concentração total de um reagente ou de
um produto.
Estes efeitos podem ser preditos qualitativamente a partir do
PRINCÍPIO DE LE CHÂTELIER, que estabelece que “a posição de um equilíbrio
químico sempre se desloca na direção que tenda a aliviar ou contrabalançar a
tensão aplicada”.
Assim, aumento da temperatura altera as relações de concentração na direção que
tende a ABSORVER CALOR, e AUMENTO DE PRESSÃO FAVORECE AOS
PARTICIPANTES QUE OCUPAM UM VOLUME TOTAL MENOR.
6](https://image.slidesharecdn.com/equilbrio-qumico-131222083302-phpapp02/85/Equilibrio-quimico-6-320.jpg)

![http://professorbomfim.no.comunidades.net/index.php
TELEFONE: (21)8507-8891
EFEITO DA CONCENTRAÇÃO NOS EQUILÍBRIOS
O valor de uma Keq não depende das CONCENTRAÇÕES DE REAGENTES E
PRODUTOS. No entanto, a POSIÇÃO DO EQUILÍBRIO É DEFINITIVAMENTE
MUITO INFLUENCIADA PELAS CONCENTRAÇÕES. A DIREÇÃO DA MUDANÇA É
FACILMENTE PREVISÍVEL A PARTIR DO PRICÍPIO DE LE CHÂTELIER
EXEMPLO
BrO3– + 2 Cr3+ + 4H2O
↔
Br– + Cr2O72– + 8H+
cuja Keq vem dada por
K =
[Br − ] [Cr2 O 2 − ] [H+ ]8
7
−
[BrO 3 ] [Cr 3 + ]2
= 1 x 1011 a 25 º C
Em um estado de equilíbrio particular deste sistema, existem as concentrações
seguintes:
[H+] = 5,0 M
Cr2O72– = 0,1 M
[Br–] = 1,0 M
[Cr3+] = 0,003 M
[BrO3–] = 0,043 M
Suponha-se que o equilíbrio é perturbado adicionando dicromato à solução para
aumentar a concentração de Cr2O72– desde 0,1 para 0,2 M. EM QUÊ SENTIDO
PROCEDERÁ A REAÇÃO PARA ALCANÇAR O EQUILÍBRIO? Segundo o
Princípio de Le Châtelier, a reação deve ocorrer para a esquerda a fim de
compensar parcialmente o incremento de dicromato, que está no lado direito da
equação. Podemos comprovar algebricamente escrevendo o quociente de reação Q,
que toma a mesma forma que a Keq. A única diferença é que Q se calcula
considerando quaisquer concentrações que existam na solução. Quando o sistema
atinge o equilíbrio, Q = Keq Para a reação em questão,
Q = 2 x 1011 > Keq
Devido a Q > Keq, a reação deve proceder para a esquerda para que diminua o
numerador e aumente o denominador, até Q = Keq.
Em geral,
I)
Se uma reação se encontra em equilíbrio e se adicionam PRODUTOS (ou se
retiram reagentes), a reação procede PARA A ESQUERDA;
II)
Se uma reação se encontra em equilíbrio e se adicionam REAGENTES (ou
se retiram PRODUTOS), a reação procede PARA A DIREITA.
8](https://image.slidesharecdn.com/equilbrio-qumico-131222083302-phpapp02/85/Equilibrio-quimico-8-320.jpg)

![http://professorbomfim.no.comunidades.net/index.php
TELEFONE: (21)8507-8891
combinar em solução para formar um produto dissociável, e.g, um complexo. Um
exemplo seria a reação de Cu(II) com NH3 para formar Cu(NH3)42+(aq) (azul intenso).
A dissociação de eletrólitos fracos, ou a solubilidade de compostos
ligeiramente solúveis pode ser quantitativamente descrita por CONSTANTES DE
EQUILÍBRIO. As Keq’s para eletrólitos completamente dissolvidos e dissociados
(ionizados) são INFINITAS. Consideremos a dissociação da espécie AB
AB
↔
Keq =
[ A ] [B]
[AB]
A + B
Tem-se
Quanto maior a Keq, maior será a dissociação. Por exemplo, quanto maior a Keq de
um ácido, mais forte o ácido será.
Algumas espécies se dissociam por etapas e uma Keq pode ser escrita para
cada etapa de dissociação. Um composto A2B, por exemplo, se pode dissociar
assim:
A2B
↔
A + AB
K1 =
[ A ] [AB]
[A 2B]
1)
AB
↔
A + B
K2 =
[ A ] [B]
[AB]
2)
A CONSTANTE de DISSOCIAÇÃO GLOBAL do composto será a soma desses 2
equilíbrios:
A2B
↔
2A + B
[ A ]2 [B]
Keq =
[A 2B]
3)
Multiplicando as equações 1) e 2), chegamos a Keq total
Ktotal
[ A ] [AB] [ A ] [B] [ A ]2 [B]
= K1 x K2 =
=
[AB]
[A 2B]
[A 2B]
3)
Quando espécies químicas dissociam por etapas como aqui, as Keq’s
sucessivas tornam-se progressivamente menores. Note que em cálculos de
equilíbrios, sempre usamos concentrações das soluções em MOLARIDADE, M.
Se uma reação se escreve como a inversa de outra, aplica o mesmo
equilíbrio, mas a Keq é a inversa:
10](https://image.slidesharecdn.com/equilbrio-qumico-131222083302-phpapp02/85/Equilibrio-quimico-10-320.jpg)
![http://professorbomfim.no.comunidades.net/index.php
↔
A + B
Para
AB
Keq =
TELEFONE: (21)8507-8891
[AB]
1
=
[A] [B]
K eq de AB
CÁLCULOS UTILIZANDO CONSTANTES DE EQUILÍBRIO
Antes de entrarmos em problemas específicos usando Keq ‘s, vale a pena considerar
como proceder ou como deveríamos proceder para resolver problemas.
Com bastante freqüência, a abordagem é procurarmos uma fórmula simples na qual
todos os dados podem ser plugados e resolver para obtermos uma resposta final.
Muito embora esta abordagem possa funcionar com problemas elementares de uma
etapa, é desastrosa com problemas multietapas mais complicados. Aprender a
resolver problemas químicos − e mais especificamente problemas de equilíbrios − é
algo similar a um marceneiro aprendendo a construir casas. Um bom marceneiro
pode construir uma casa que nunca antes viu ou construiu porque ele está
familiarizado e tem experiência com muitas operações mais simples, tal como
enquadrar uma porta, construir uma parede, fazer um alicerce, e levantar um teto, e
é capaz de selecionar e efetuar essas operações em uma seqüência tal que levará
finalmente à casa desejada. Bons cientistas usam um método semelhante para
resolver problemas científicos. Experiência em resolver problemas (significando
dever de casa) é, da mesma forma, tão importante ao estudante de química como a
experiência em construir é para o marceneiro novato.
Um
dos
usos
CONCENTRAÇÕES
de
mais
comum
substâncias
das
NO
Keq‘s
é
EQUILÍBRIO
a
determinação
a
partir
de
de
suas
11](https://image.slidesharecdn.com/equilbrio-qumico-131222083302-phpapp02/85/Equilibrio-quimico-11-320.jpg)
![http://professorbomfim.no.comunidades.net/index.php
TELEFONE: (21)8507-8891
CONCENTRAÇÕES ANALÍTICAS. Para ilustrar, consideremos uma substância AB
que se dissocia em A e B quando dissolvida em água
AB
↔
A + B
As concentrações no equilíbrio podem ser calculadas da Keq para a reação de
dissociação:
Keq =
[ A ] [B]
[AB]
Para acharmos [A], as grandezas [B] e [[AB] devem ser expressas em função da
incógnita. Se a única fonte de A e B é a dissociação de AB, suas concentrações
devem ser iguais:
[A] = [B]
. A concentração de AB = CAB − Concentração de AB perdida na dissociação. Mas,
[AB] dissociada é igual [A] (ou [B]).
∴ [AB] = CAB − [A]
[ A ]2
Keq =
C AB - [A]
4)
ou
[A]2 + Keq [A] − CAB Keq = 0
Se a Keq e CAB são conhecidos, a equação pode ser resolvida.
APROXIMAÇÃO POSSÍVEL: com freqüência é possível fazer SUPOSIÇÕES
para simplificar a Eq. 4) sem modificar significativamente a resposta final. Nosso alvo
é o denominador onde um valor está sendo subtraído de outro. É comum o caso em
que CAB >> [A], o que significa que
5)
CAB – [A] ≈ CAB
∴ Keq
[ A ]2
≈
C AB
e
[A] =
C ABK eq
Lembre que para a aproximação ser viável, não é uma questão da [A] ser pequena,
mas se ela é PEQUENA COMPARADA À CONCENTRAÇÃO DA QUAL ESTÁ
SENDO SUBTRAÍDA (ou ADICIONADA), neste caso CAB.
É crucial aprender a reconhecer e avaliar suposições deste tipo porque elas
são encontradas repetidamente em problemas de equilíbrios. Em geral, se a Keq é
1000 vezes menor que CAB, (Keq × 1000 < CAB) pode-se considerar pequena,
validando a aproximação feita na Eq. 5)
Exemplo 1. Uma solução se preparou dissolvendo 0,20 mol de NaHSO4 em
água e diluindo para 1,0 L. Se a Keq para a dissociação do HSO4- é 1,02 × 10-2,
Calcular a [H+] a) com, e b) sem a suposição da Eq. 5).
12](https://image.slidesharecdn.com/equilbrio-qumico-131222083302-phpapp02/85/Equilibrio-quimico-12-320.jpg)
![http://professorbomfim.no.comunidades.net/index.php
HSO4
a)
↔
–
+
+
H + SO4
2–
2–
[H+ ] [SO 2 - ]
4
Keq =
Keq =
[H ] = [SO4 ]
TELEFONE: (21)8507-8891
[HSO − ]
4
[H+ ]2
C
−
HSO 4
Resolvendo a equação quadrática, sabendo-se que C
[H+ ]2
+
0,200 - [H ]
= 1,02 × 10
- [H+ ]
HSO −
4
= 1,02 × 10
= 1,02 × 10
-2
-2
= 0,2 M
-2
[H+]2 + (1,02 × 10-2) [H+] − 2,04 × 10-3 = 0
R: [H+] = 4,04 x 10–2 M
b)
Se fazemos a aproximação que C
HSO −
4
- [H+ ] ≈ C
HSO −
4
[H + ] 2
-2
= 1,02 × 10 , e
0,200
R: [H+] = 4,51 x 10–2 M
Calculemos o erro ao usarmos a aproximação:
% ERRO =
4,51 - 4,04
× 100 = 11,6 %!!!! >> 5%
4,04
∴ aproximação errada!!
Exemplo 2. Uma solução de HAc 0,10 M tem uma [H+] = 1,32 x 10-3 M. Calcular a
Keq para a dissociação do HAc.
HAc
Keq =
↔
H+ + Ac–
[H + ] [Ac - ]
, dado que a dissociação é a única fonte de H+ e Ac-,
[HAc ]
[H+] = [Ac–] = 1,32 x 10-3M;
[HAc] = CHAc - [H+]
= 0,100 – 1,23 x 10-3 = 0,099 M
Substituindo esses valores na expressão da constante de equilíbrio, tem-se
Keq =
(1,32 x 10 -3 )(1,32 x 10 -3 )
-5
= 1,76 x 10
0,099
13](https://image.slidesharecdn.com/equilbrio-qumico-131222083302-phpapp02/85/Equilibrio-quimico-13-320.jpg)
![http://professorbomfim.no.comunidades.net/index.php
TELEFONE: (21)8507-8891
CÁLCULOS USANDO Keq
Reações Químicas
As vezes é útil conhecer as concentrações de reagentes e produtos no equilíbrio em
uma reação química. Por exemplo, poderíamos querer saber a quantidade de
reagente para construir uma curva de calibração, ou para calcular o potencial de um
eletrodo na solução. Alguns exemplos ilustrarão a abordagem geral para resolver
problema de equilíbrios.
Exemplo 3. Os reagentes A e B reagem como segue para produzir C e D:
A + B ↔ C + D
Keq =
[C] [D]
= 0,3
[A] [B]
Suponhamos que 0,20 mol de A e 0,05 mol de B são dissolvidos em 1 L, e a reação
se processa. Calcule as concentrações de reagentes e produtos.
Solução
CA = 0,2 M; CB = 0,5 M;
CC = CD = 0. No equilíbrio, chamaremos de X a [C] (=
[D]), ou os mol L-1 de A e B que reagiram
∴
[A] = 0,2 – X
[B] = 0,5 – X
[C] = [D] = X
[A]
[B]
[C]
[D]
INICIAL
0,20
0,50
0
0
VARIAÇÃO *
–X
–X
+X
+X
0,20 – X
0,50 – X
X
X
FINAL
* X = mmol mL–1 que reagiram
Substituindo estes valores na Keq e resolvendo para X
(X ) (X)
= 0,3;
(0,2 - X) (0,5 - X)
X2 = 0,3 [(0,1 – 0,7 X + X2]
0,7 X2 + 0,21 X – 0,03 = 0
Resolvendo a equação quadrática, X = 0,11 M, então
R: [A] = 0,2 – X = 0,09 M; [B] = 0,5 – X = 0,39 M
[C] = [D] = X = 0,11 M
Uso de aproximações sucessivas para resolver a equação quadrática:
1º Desprezar X comparado com as concentrações iniciais para simplificar os
cálculos e calcular um valor inicial para X; 2º Agora usaremos este primeiro valor
14](https://image.slidesharecdn.com/equilbrio-qumico-131222083302-phpapp02/85/Equilibrio-quimico-14-320.jpg)
![http://professorbomfim.no.comunidades.net/index.php
TELEFONE: (21)8507-8891
aproximado de X para subtraí-lo de CA e CB para obtermos uma estimativa inicial
das concentrações no equilíbrio de A e B, e calcular um novo valor de X. O processo
se repete até que X tende a um valor essencialmente constante.
(X ) (X)
= 0,3
(0,2 ) (0,5)
1º Cálculo
∴
X0 = 0,173
2º Cálculo
(X) (X)
= 0,3
(0,2 - 0,173) (0,5 - 0,173)
X1 = 0,051
(X) (X)
= 0,3
(0,2 - 0,051) (0,5 - 0,051)
X2 = 0,142
(X) (X)
= 0,3
(0,2 - 0,142) (0,5 - 0,142)
X3 = 0,079
3º Cálculo
4º Cálculo
5º Cálculo: X4 = 0,124
Neste exemplo os valores oscilam demais: tomar a média entre o 1º e 2º valor para
a 3ª iteração. Isto dará um valor mais próximo dói valor final (0,112 neste caso)
Neste exemplo quantidade apreciável de A fica, embora B esteja em excesso. Isto
porque a Keq não é muito grande. Na maioria das reações analíticas de interesse as
Keq’s são grandes e o equilíbrio está muito deslocado para a direita. Nesses casos,
as concentrações de equilíbrio dos reagentes que não estão em excesso são
geralmente muito pequenas comparadas às outras concentrações. Isto simplifica
nossos cálculos.
Exemplo 4. Suponha que no problema anterior a Keq é 2 x 1016. Calcule as
concentrações de A, B, C, e D no equilíbrio.
Solução
Dado que a Keq é muito grande, a reação de A com B será virtualmente completa,
deixando apenas traços de A no equilíbrio. Representaremos por X a [A]. Uma
quantidade de B igual a A reagirá para formar uma quantidade equivalente de C e D
(ca. 0,20 M de cada). Resumindo
[A] = X
[B] = (0,5 – 0,2) + X = 0,3 + X
15](https://image.slidesharecdn.com/equilbrio-qumico-131222083302-phpapp02/85/Equilibrio-quimico-15-320.jpg)
![http://professorbomfim.no.comunidades.net/index.php
TELEFONE: (21)8507-8891
[C] = 0,2 – X
[D] = 0,2 – X
ou, observando a equação de equilíbrio:
A
+
X
↔
B
(0,3 + X)
C
+
(0,2 – X)
D
(0,2 – X)
Basicamente dizemos que todo se tem convertido em uma quantidade similar de C e
D, exceto por uma pequena quantidade X. Agora X será muito pequena comparada
com 0,2 e 0,3 e pode ser desprezada. Pode-se dizer então que:
[A] ≈ X
[B] ≈ 0,3
[C] ≈ 0,2
[D] ≈ 0,2
A única incógnita é a concentração de A. Substituindo na Keq, tem-se
(0,2) (0,2)
= 2 x 1016
(X ) (0,3)
∴ X = 6,7 x 10-18 M (não detectável)
Exemplo 5. A e B reagem assim:
A + 2B ↔
2C
K=
[ C ]2
[A] [B]2
Suponhamos que 0,10 mol de A reage com 0,20 mol de B em um volume de 1000
mL; K = 1,0 x 1010. Quais as concentrações de A, B, e C no equilíbrio?
Solução
Temos quantidades estequiométricas de A e B, conseqüentemente reagem
completamente, deixando apenas traços. Consideremos que X representa a [A]. No
equilíbrio tem-se
A
x
+
2B
↔
2x
2C
(0,2 – 2x) ≈ 0,2
Por cada mol de A que reage ou é produzido, produzimos ou removemos 2 moles de
C, e consumimos ou produzimos 2 moles de B. Substituindo isso na Keq
(0,2)2
(X) (2X)
2
= 1,0 x 1010
4 x 10 − 2
X = [A] = 3
= 1,0 x 10-4 M
10
4 x 10
[B] = 2 X = 2,0 x 10-4 M (detectável)
16](https://image.slidesharecdn.com/equilbrio-qumico-131222083302-phpapp02/85/Equilibrio-quimico-16-320.jpg)
![http://professorbomfim.no.comunidades.net/index.php
TELEFONE: (21)8507-8891
Equilíbrios de Dissociação
Cálculos envolvendo espécies que se dissociam não são muito diferentes aos
exercícios vistos para reações química.
Exemplo 6. Calcular as concentrações de A e B no equilíbrio de uma solução 0,1 M
de um eletrólito fraco AB com uma Keq = 3,0 x 10-6.
Solução.
[ A ] [B]
[AB]
[A] e [B] são desconhecidas e iguais. Sejam suas concentrações no equilíbrio igual a
AB
↔
A + B
Keq =
X. A concentração de [AB] = CAB - X
AB
(0,1 – x)
↔
A + B
x
x
Keq =
[ A ] [B]
[AB]
A Keq é bastante pequena, assim provavelmente se justifique desprezar x
comparado com 0,1. Caso contrário, teríamos que resolver a equação quadrática.
Substituindo na Keq:
Keq =
(X ) (X )
= 3 x 10–6
(0,1 )
[X] = [A] = [B] = 5,5 x 10-4 M
O EFEITO DO ÍON COMUM
Equilíbrios podem ser marcadamente afetados pela adição de uma ou mais espécies
presentes, com predito pelo Princípio de Le Châtelieur.
Embora o valor da Keq seja CONSTANTE a uma dada temperatura e pressão,
A POSIÇÃO DO EQUILÍBRIO, indicada pelas concentrações de reagentes e
produtos, PODE VARIAR. Por exemplo, suponhamos que soluções de A e B se
misturam e a reação aA + bB
↔
cC +
dD procede até se estabelecer o
equilíbrio. A adição de mais A levará a um aumento da VELOCIDADE DA REAÇÃO
DIRETA (para a direita). Não há mudança imediata na velocidade da reação inversa
porque as concentrações de C e D não foram mudadas. Já que as velocidades das
reações direta e oposta NÃO SÃO MAIS IGUAIS, uma reação líquida deve ocorrer
até se atingir uma nova condição de equilíbrio. As concentrações de A, B, C, e D
serão diferentes de seus valores originais, MAS SUA RAZÃO PERMANECERÁ a
mesma de acordo com a Keq, i.e., a Keq NÃO MUDA.
Este assim chamado EFEITO DO ÍON COMUM se encontra com freqüência na
17](https://image.slidesharecdn.com/equilbrio-qumico-131222083302-phpapp02/85/Equilibrio-quimico-17-320.jpg)
![http://professorbomfim.no.comunidades.net/index.php
TELEFONE: (21)8507-8891
química de soluções e influencia a forma de resolver problemas de equilíbrio.
Exemplo 7. Suponhamos que AB (eletrólito fraco) se dissolve em água junto com
algo de seu íon comum B e queremos achar a concentração de A no equilíbrio. A
reação de dissociação e a Keq vêm dadas por:
Solução:
↔
AB
A + B
Keq =
[ A ] [B]
[AB]
Para este cálculo precisamos conhecer Keq, [B], e [AB].
Sabíamos que a [A] = [B], mas esse não é o caso agora porque TEMOS 2 FONTES
de B: a acrescentada à solução, cuja concentração analítica é CB, e aquela formada
pela dissociação de AB, cuja concentração ainda não é conhecida, mas é igual à [A]
∴
no equilíbrio, [B] = CB + [A]
A [AB] é igual a CB − CONC. DE AB IONIZADA:
[AB] = CAB − [A]
Substituindo na Keq
Keq =
ou
[ A ](CB + [A])
C AB - [A]
[A]2 + (CB + Keq) [A] − Keq CAB = 0
Embora esta equação possa ser resolvida sem problema, com freqüência pode ser
simplificada. Se [A] << CB e CAB, então
[B] ≈ CB
1)
[AB] ≈ CAB
2), e
Keq =
[ A ] CB
C AB
3)
Exemplo 8. a) Uma solução de HAc 0,10 M também contém 0,200 M de NaAc.
Calcule a [H+] da solução
b) Quê peso de NaAc deve ser adicionado a 250 mL de HAc 0,10 M
para se obter uma [H+] = 2,25 x 10-4 M?
Solução.
a)
−
HAc + H2O ↔ Ac + H3O
CHAc = 0,10 M;
+
[H+ ] [Ac - ]
Keq =
[HAc ]
CAc = 0,200 M
+
[HAc] = 0,1 - [H3O ]
[Ac-] =
0,200 + [H3O+]
Fazendo as mesmas aproximações do Exemplo 7, e substituindo na Keq, tem-se
18](https://image.slidesharecdn.com/equilbrio-qumico-131222083302-phpapp02/85/Equilibrio-quimico-18-320.jpg)
![http://professorbomfim.no.comunidades.net/index.php
Keq =
TELEFONE: (21)8507-8891
[H+ ] 0,200
= 1,76 x 10-5
0,10
R: [H+] = 8,80 x 10-6 M
b)
Se fazemos as aproximações usuais, podemos usar as
concentrações analíticas em lugar das concentrações de equilíbrio:
[H+ ] C
Keq =
Ac -
CHAc
Resolvendo esta equação para C
[H+ ] C
Ac -
= 1,76 x 10-5 e
0,10
Ac -
C
, obteremos
Ac -
= 7,82 x 10-3 M. A quantidades desse sal em
mmoles será
quantidade da NaAc = (7,82 x 10-3) (250 mL) = 1,96 mmol,
Passando essa quantidade para massa dá
peso de NaAc = (1,96 mmol) (82,0 mg mmol-1) = 161 mg
O efeito de íon comum pode ser usado para fazer as reações analíticas mais
favoráveis ou quantitativas. O ajuste da acidez, por exemplo, é usado
freqüentemente para deslocar um equilíbrio. As titulações com K2Cr2O7 são
efetuadas em meio ácido porque prótons são consumidos nessas reações.
Titulações com I2 (um oxidante fraco) são processadas em meio ligeiramente
alcalino para deslocar o equilíbrio até completa reação com o redutor, e.g., titulação
de As(III).
I2 + H3AsO3 + H2O
2I− + H3AsO4 + 2H+
Keq ≈ 1
MÉTODO SISTEMÁTICO PARA CALCULAR EQUILÍBRIOS
Agora que ganhamos uma certa familiaridade com problemas de equilíbrio
vamos
a
considerar uma ABORDAGEM SISTEMÁTICA
para
calcular as
concentrações de equilíbrio que funcionará bem com TODOS OS EQUILÍBRIOS,
não importando quão complexos eles sejam. Consiste em identificar as
concentrações desconhecidas envolvidas e escrever um conjunto de equilíbrios
19](https://image.slidesharecdn.com/equilbrio-qumico-131222083302-phpapp02/85/Equilibrio-quimico-19-320.jpg)
![http://professorbomfim.no.comunidades.net/index.php
TELEFONE: (21)8507-8891
simultâneos igual ao número de incógnitas. Suposições são feitas para simplificar os
cálculos comparando as concentrações relativas das espécies (não muito diferente
dos que já temos efetuado) para abreviar a resolução das equações. Este
tratamento envolve escrever EXPRESSÕES PARA OS BALANÇOS DE MASSA
DAS ESPÉCIES e o BALANÇO DE CARGA DAS ESPÉCIES como parte do
sistema de equações.
Ainda, em sistemas ácido-base, onde os íons do solvente (água) participam nos
equilíbrios,
é
necessário
escrever
uma
relação
denominada
BALANÇO
PROTÔNICO ou CONDIÇÃO PROTÔNICA que envolve pelo menos um dos íons do
solvente.
Vamos ver como obter essas expressões!!!
BALANÇO DE MASSA (B.M.)
Estabelece que o número de átomos de uma certa classe DEVE PERMANECER
CONSTANTE através das reações químicas ordinárias. Se um grupo de átomos, tal
como sulfato ou acetato permanece intacto, poderia ser usado também para o B.M.
Isto nada mais é que uma aplicação prática do PRINCÍPIO DE CONSERVAÇÃO DA
MATÉRIA que estabelece que “o número de átomos de um elemento ou de um
conjunto de átomos fica CONSTANTE nas reações químicas comuns, porque
ÁTOMOS NÃO SÃO PRODUZIDOS NEM DESTRUÍDOS”. Este princípio exprimese matematicamente igualando as concentrações, em mol L-1. Escrevem-se as
equações para todos os equilíbrio pertinentes a partir das quais relações
apropriadas entre as espécies são escritas.
Exemplo 9. Escrever o(s) balanço(s) de massa para uma solução de HAc 0,100 M.
Solução.
HAc
↔
H+ + Ac−
1)
H2O
Os equilíbrio envolvidos são
↔
H+ + OH−
2)
A concentração analítica CHAc será igual à SOMA das CONCENTRAÇÕES no
EQUILÍBRIO de TODAS as ESPÉCIES que CONTÉM o GRUPO ACETATO:
CHAc = [HAc] + [Ac−] = 0,100 M
Um segundo balanço de massa pode ser escrito para a concentração de equilíbrio
do íon H+, que deriva de ambos HAc e H2O.
Obtemos 1 H+ por cada Ac- e por cada OH- formados [ver Eqs. 1) e 2)] , já que as
únicas fontes dessas espécies são HAc e H2O, respectivamente. Então
20](https://image.slidesharecdn.com/equilbrio-qumico-131222083302-phpapp02/85/Equilibrio-quimico-20-320.jpg)
![http://professorbomfim.no.comunidades.net/index.php
TELEFONE: (21)8507-8891
[H+] = [Ac−] + [OH−]
Exemplo 10. Escreva as equações do balanço de massa para uma solução 1,00 x
10-5 M de [Ag(NH3)2]Cl.
Solução.
Os equilíbrios envolvidos são
[Ag(NH3)2]Cl → Ag(NH3)2+ + Cl−
Ag(NH3)2+
↔
Ag(NH3)+ + NH3
Ag(NH3)+
↔
Ag+ + NH3
NH3 + H2O ↔
NH4+ + OH−
A [Cl−] é igual à concentração do sal (1,00 × 10-5 M) já que este se dissocia
completamente (eletrólito forte). Também a soma das concentrações de todas as
espécies que contêm Ag+ é igual a 1,00 × 10-5 M, i.e., igual à concentração de Ag no
sal original que se dissocia:
B.M. (Ag)
C[ Ag(NH3 )2 ]Cl = [Ag+] + [Ag(NH3)2+] + [Ag(NH3)+] = 1,0 x10-5
Tem-se as seguintes espécies contendo N:
NH3, NH4+, Ag(NH3)+, Ag(NH3)2+
A concentração de N da última espécie é 2 vezes a concentração de Ag(NH3)2+. A
concentração total de N é duas vezes a concentração original do sal já que este
contém 2 moles de NH3 por cada mol de sal. Assim
B.M(NH3) CNH3 = [NH3] + [NH4+] + 2[Ag(NH3)2+] + [Ag(NH3)2+] = 2,0 x10-5
Finalmente,
B.M. (OH)
[OH-] = [NH4+] + [H+]
Quando existem duas fontes do mesmo átomo ou grupo, a soma das
concentrações da espécie em questão no equilíbrio será igual à soma das
concentrações analíticas.
Exemplo 11. B.M. para uma solução que se preparou misturando CHAc M de HAc e
CNaAc de NaAc (acetato de Na)
Solução.
B.M.(Ac)
[HAc] + [Ac−] = CHAc + CNaAc
BALANCO DE CARGA.
Conforme estabelece o PRINCÍPIO DE ELETRONEUTRALIDADE, todas as
soluções são ELETRICAMENTE NEUTRAS, i.e., não existe solução que contenha
um excesso detectável de carga positiva ou negativa, porque a soma das cargas
21](https://image.slidesharecdn.com/equilbrio-qumico-131222083302-phpapp02/85/Equilibrio-quimico-21-320.jpg)
![http://professorbomfim.no.comunidades.net/index.php
TELEFONE: (21)8507-8891
positivas iguala a soma das cargas negativas. PODEMOS ESCREVER SÓ UMA
EQUAÇÃO SIMPLES do BALANÇO DE CARGAS PARA UM CONJUNTO DADO DE
EQUILÍBRIOS.
FORMA GERAL DO BALANÇO DE CARGAS (B.C.) para qualquer solução
n1 [C1] + n2 [C2] + n3 [C3]
= m1 [A1] + m2 [A2] + -----
[Ci], [Ai]: concentrações do cátion e ânion, respectivamente
ni, mi: carga do cátion e ânion, respectivamente
Exemplo 12. Escrever a equação do B.C. para uma solução de H2S
Solução
H2S
↔
HS− + H+
HS−
↔
H+ + S2−
H2O
↔
H+ + OH−
−
B.C. + [H+] = 2[S2−] + [HS−] + [OH−]
Notar que apesar de existir mais de uma fonte de H+ a carga total de todas as fontes
é sempre igual à concentração de equilíbrio líquida da espécie multiplicada pela sua
carga.
Exemplo 13. Escreva a expressão do B.C. para uma solução que contém KCl,
Al2(SO4)3, e KNO3. Desprezar a dissociação d’água.
Solução.
B.C. [K+] + 3[Al3+]
= [Cl-] + 2 [SO42-] + [NO3-]
BALANÇO PROTÔNICO (ou CONDIÇÃO PROTÔNICA), C.Pr.
Os princípios dos equilíbrios ácido-base são bem conhecidos: são eles a lei de ação
de massa de Guldberg e Waage e os princípios de conservação de massa e
carga. Nos problemas ácido-base as relações dos balanços de massa e carga
podem ser combinadas em uma simples expressão apropriada para resolver
problemas ácido-base. O uso do balaço protônico (também chamado de condição
protônica) foi promovido por Butler e é a base da presente abordagem.
22](https://image.slidesharecdn.com/equilbrio-qumico-131222083302-phpapp02/85/Equilibrio-quimico-22-320.jpg)
![http://professorbomfim.no.comunidades.net/index.php
TELEFONE: (21)8507-8891
O balanço protônico é uma equação que lista, de um lado, todas as espécies que
têm ganhado UM OU MAIS PRÓTONS (com respeito aos materiais de partida) e,
do outro lado, todas as espécies que têm perdido UM OU MAIS PRÓTONS
Isto é simplesmente uma expressão do requerimento de que o número total de
próton intercambiados (trocados) deve permanecer constante. O balanço protônico
freqüentemente pode ser escrito por inspeção e pode ser sempre obtido das
relações dos balanços de massa e carga.
Sua utilidade na resolução de problemas deriva do fato que ele omite a
concentração de quaisquer íons espectadores, (tal como contra-íons de ácidos e
bases fortes, por exemplo, Na+ ou Cl – ) que não contribuem diretamente ao pH. Por
exemplo, para um simples ácido forte como HCl, temos
[H+] = [Cl–] + [OH–];
Analogamente, para um ácido fraco simples, HA, tem-se:
[H+] = [A–] + [OH–]
Para um ácido diprótico simples, H2A, encontramos
[H+] = [HA–] + 2[A2–] + [OH–],
enquanto que o balance protônico para uma mistura de um ácido monoprótico HA e
um ácido diprótico fraco H2A’ é
[H+] = [A–] + [HA′–] + 2[A′2–] + [OH–].
Nos exemplos anteriores o balanço protônico é idêntico à expressão do balanço de
cargas, mas isto nem sempre é assim.
Agora escrevemos o balanço protônico na forma padrão movendo todos os
termos para o lado que contêm o termo [H+], o que pode ser escrito como HC = 0.
Nos exemplos anteriores, deveríamos escrever
H
C = [H+] – [Cl–] – [OH–]
for a solution of HCl and
H
C = [H+] – [A–] – [OH–]
para a solução de um ácido monoprótico simples;
H
C = [H+] – [HA–] – 2[A2–] – [OH–]
para um ácido diprótico, H2A, e
H
C = [H+] – [A–] – [HA’–] – 2[A’2–] – [OH–]
para uma mistura de um ácido monoprótico HA, e um ácido diprótico fraco HA’2.
23](https://image.slidesharecdn.com/equilbrio-qumico-131222083302-phpapp02/85/Equilibrio-quimico-23-320.jpg)
![http://professorbomfim.no.comunidades.net/index.php
TELEFONE: (21)8507-8891
H
C é a função protônica. Claramente, o pH pode ser obtido expressando
H
C
explicitamente em termos da [H+] e resolvendo subseqüentemente a expressão
resultante para HC = 0. Nos exemplos supracitados, poderíamos escrever
H
C = [H+] – C – Kw/[H+] = 0 para C M de HCl,
H
C = [H+] – KaC/([H+]+Ka) – Kw/[H+] = 0 para C M de HA
H
C = [H+] – ([H+]Ka1+2Ka1Ka2) C/([H+]2+[H+]Ka1+Ka1Ka2) – Kw/[H+] = 0 para C M de H2A
H
C = [H+] – KaC1/([H+]+Ka) – ([H+]Ka1+2Ka1Ka2)C2/([H+]2 + [H+]Ka1+Ka1Ka2) – Kw/[H+] =0
para C1 M HA + C2 M de H2A′
Em outras palavras, podemos distinguir entre balanço protônico e função protônica.
Usaremos o termo BALANÇO PROTÔNICO para a equação contendo
concentrações de ganhadores de prótons de um lado do sinal igual e às
concentrações correspondentes aos perdedores de prótons no outro.
Definiremos a FUNÇÃO PROTÔNICA como a função que obtemos a partir do
balanço protônico trazendo todas os termos das concentrações para um lado, de
forma tal que as concentrações de todos os ganhadores de prótons terão sinais
positivos (especificamente, o termo [H+] deveria ter o coeficiente + 1), e logo
apagando a parte que lê = 0. A função protônica HC é, então, a soma algébrica dos
termos de concentração.
Há 4 métodos de obtermos a C.Pr. Primeiro, fazendo o balanço de massa dos H+ ou
dos OH-. O B.M(H) não é trivial porque H2O está presente em um excesso
essencialmente ilimitado e deve existir uma forma de seguir a pista (monitorar)
quanto H+ provém da ionização d’água e quanto da ionização do ácido. Se não há
uma fonte externa de OH− (tal como NaOH ou NH3), podemos utilizar o fato de que
por cada molécula de água que se ioniza ela produz 1 H+ e 1 OH−. Por exemplo, em
uma solução C M de HCl, o ácido está completamente ionizado em H+ e Cl−, então
C.Pr.
[H+] =
C
+ [OH−]
do ácido
d’água
+
Isto quer dizer que todos os H da solução vêm do ácido (C), e da dissociação
d’água (1 H+ por cada 1 OH−)
24](https://image.slidesharecdn.com/equilbrio-qumico-131222083302-phpapp02/85/Equilibrio-quimico-24-320.jpg)
![http://professorbomfim.no.comunidades.net/index.php
TELEFONE: (21)8507-8891
Em forma similar, se não há uma fonte externa de H+ (HCl ou HAc), podemos efetuar
um B.M.(OH). Por exemplo, de uma solução C M de NaOH (completamente
dissociada):
C.Pr.
[OH−] =
C
[H+]
+
da base
d’água
Onde C é o nº de moles provenientes do NaOH e 1 H+ por cada OH− formado pela
dissociação d’água.
Podemos estender esta idéia Por exemplo, para uma solução que contém íon Hg
2+
;
as seguintes reações acontecem:
H2O
↔
H+ + OH−
Hg2+ + H2O ↔
H+ + HgOH+
Hg2+ + 2 H2O ↔ 2 H+ + Hg(OH)2
Um B.M.(H+) pode ser obtido usando o seguinte raciocínio: por cada OH−, um H se
+
forma pela dissociação d’água; por cada HgOH+, 1 H+ é formado pela reação de
Hg2+ com H2O; por cada Hg(OH)2, 2H+ são formados pela reação de Hg2+ com H2O.
∴ C.Pr.
[H+]
[OH−] + [HgOH+] + 2 [Hg(OH)2]
que será válido para soluções de Hg(NO3)2 ou soluções de HgCl2 na qual muitos
íons complexos se formam.
Na resolução de problemas envolvendo SAIS DE ÁCIDOS OU BASES FRACOS é
mais conveniente obter a C.Pr. considerando a transferência de prótons entre as
espécies na solução. Por exemplo, uma solução aquosa de NaCN.
O NIVEL ZERO DE PRÓTONS se define como as ESPÉCIES A PARTIR DAS
QUAIS A SOLUÇÃO É PREPARADA. No presente caso o nível zero será: H2O e
CN−. As outras espécies classificam-se como tendo EXCESSO de prótons ou
DEFICIÊNCIA de prótons, de acordo a se eles se formaram a partir do nível zero
adicionando ou subtraindo prótons, respectivamente.
Assim, HCN forma-se a partir do nível zero CN− adicionando 1 H+; H3O+ (H+)
forma-se pela adição de 1 H+ ao nível zero H2O, finalmente OH− obtém-se pela
subtração de 1 H+ ao nível zero H2O.
C.Pr.
+
+
∑ espécies com mais H que nível 0 = ∑ espécies com menos H que nível 0
∴
[OH−] = [H+] + [HCN]
25](https://image.slidesharecdn.com/equilbrio-qumico-131222083302-phpapp02/85/Equilibrio-quimico-25-320.jpg)