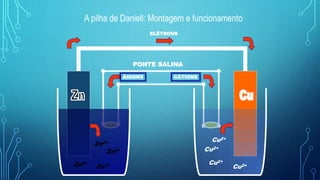
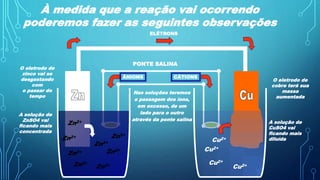
O documento discute os principais conceitos de eletroquímica, incluindo oxidação, redução e pilhas. Ele descreve detalhadamente o funcionamento da pilha de Daniell, incluindo suas reações, montagem e como mede a força eletromotriz. Também aborda o eletrodo padrão de hidrogênio, cálculo da força eletromotriz, espontaneidade das reações e diferentes tipos de pilhas. Por fim, discute a corrosão dos metais.