Estrutura atómica
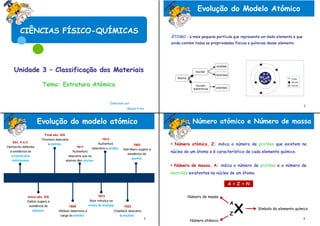
- 1. CIÊNCIAS FÍSICO-QUÍMICAS Unidade 3 – Classificação dos Materiais Tema: Estrutura Atómica Elaborado por: - Raquel Pires Evolução do modelo atómico Número atómico e Número de massa Final séc. XIX Thomson descobre 1914 Séc. V a.C. o eletrão. Rutherford 1963 Número atómico, Z: indica o número de protões que existem no Demócrito defendia 1911 descobre o protão. Gell-Mann sugere a a existência de Rutherford existênica de núcleo de um átomo e é característico de cada elemento químico. corpúsculos descobre que os quarks. indivisíveis. atomos têm núcleo. Número de massa, A: indica o número de protões e o número de neutrões existentes no núcleo de um átomo. A = Z + N Início séc. XIX 1913 Número de massa X A Dalton sugere a Bohr introduz os existência de 1909 níveis de energia. 1932 átomos. Símbolo do elemento químico Millikan determina a Chadwick descobre carga do eletrão. o neutrão. Z 3 4 Número atómico
- 2. Isótopos Dimensão dos átomos Isótopos: átomos do mesmo elemento químico (têm o mesmo Massa dos átomos número atómico) que diferem no número de neutrões (diferente número de massa). Massa de um átomo de hidrogénio (11H) 0, 000 000 000 000 000 000 000 017 g = 1,7 x 10 -24 g Isótopos de hidrogénio 1 protão 1 protão 1 protão 1 2 3 1 H 1 eletrão 0 neutrões 1 H 1 eletrão 1 neutrão 1 H 1 eletrão 2 neutrões Processo de comparação Hidrogénio 1 (valor unitário) Hidrogénio-1 Hidrogénio-2 Hidrogénio-3 ou ou ou Prótio Deutério Trítio 5 6 Dimensão dos átomos Massa atómica relativa, Ar (X): indica o número de vezes que a massa média dos átomos desse elemento é maior do que a massa do padrão escolhido. Nota: Massa atómica relativa de isótopos 63Cu – 69,2% 65Cu – 30,8% Ar (Cu) = 63 x 0,692 + 65 x 0,308 = 63,6 Exercício: Calcula a massa atómica relativa do magnésio sabendo que 24Mg – 79%, 25Mg – 10% e 26Mg – 11%. 8
- 3. Distribuição Eletrónica Exemplos: 9F Z = 9 9 eletrões Distribuição eletrónica: 2 – 7 7 eletrões de valência 12Mg 2 – 8 - 2 2 eletrões de valência 18Ar 2 – 8 – 8 8 eletrões de valência 20Ca 2 – 8 – 10 2 – 8 – 8 – 2 2 eletrões de valência X Notas: No último nível de energia, qualquer que ele seja, o número máximo de eletrões é oito. Eletrões de valência: são os eletrões do último nível de energia, responsáveis pelas propriedades químicas dos elementos. 10 Formação de iões Formação de iões Que átomos têm tendência para formar catiões? E aniões? Os átomos são partículas eletricamente neutras porque o número de protões é igual ao número de eletrões. Relembrar: O último nível de energia pode conter no máximo 8 eletrões. Contudo, um átomo pode ganhar ou perder eletrões transformando- Os átomos com 8 eletrões de valência são muito estáveis. se num ião. Perde Ião positivo Átomo eletrões (catião) Conclusão: Os átomos têm tendência a transformarem-se em iões, cedendo ou Ganha Ião negativo Átomo recebendo eletrões de forma que a sua nuvem electrónica passa a ter eletrões (anião) 8 eletrões de valência, tornando-se mais estáveis. 11 12
- 4. Formação de iões Formação de iões 11Na 2 – 8 - 1 1 eletrão de valência 11Na+ 2 – 8 8 eletrões de valência 12Mg 2 – 8 - 2 2 eletrões de valência 12Mg2+ 2 – 8 8 eletrões de valência 11 eletrões 10 eletrões 12 eletrões 10 eletrões 13 14 Formação de iões Formação de iões 9F 2 – 7 7 eletrões de valência 9F- 2 – 8 8 eletrões de valência 9 eletrões 10 eletrões 11Na+ 2 – 8 8 eletrões de valência 10 eletrões 12Mg2+ 2 – 8 8 eletrões de valência Partículas isoeletrónicas: 10 eletrões Partículas que apresentam a 9 F- 2 – 8 8 eletrões de valência mesma distribuição eletrónica. 10 eletrões 15 16
- 5. Raio atómico e raio iónico Resolve… 11Na 9F Carga do ião Distribuição Representação Símbolo Número Número Carga Distribuição Eletrões que tem Elemento eletrónica simbólica químico protões eletrões nuclear eletrónica valência tendência a do ião do ião formar Lítio Li 3 3 + 3 2 - 1 1 + 1 2 Li+ Oxigénio O 8 8 + 8 2 - 6 6 - 2 2 – 8 O2- Cloro Cl 17 17 + 17 2 – 8 - 7 7 - 1 2 – 8 Cl- 11Na 9F + - Cálcio Ca 20 20 + 20 2 – 8– 8- 2 2 + 2 2 – 8 - 8 Ca2+ Conclusão: Raio (átomo) > Raio (catião) Raio (átomo) < Raio (anião) 17 18