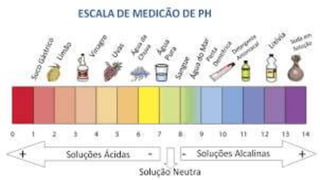
Este documento define bases químicas e discute suas propriedades. Uma base libera íons hidroxila em solução aquosa e tem pH acima de 7, conduzindo eletricidade. Bases fortes como hidróxido de sódio são corrosivas, enquanto bases fracas como hidróxido de magnésio são seguras. O documento também explica a escala pH e como Bronsted, Lowry e Lewis contribuíram para definir bases.