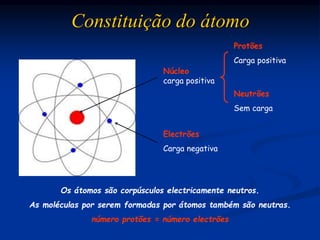
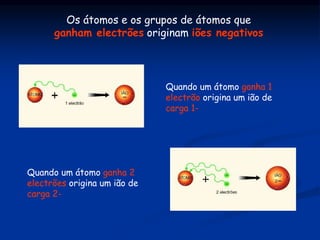
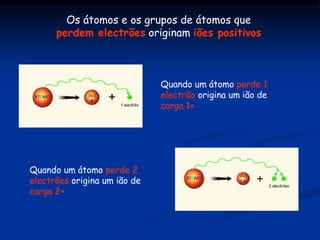
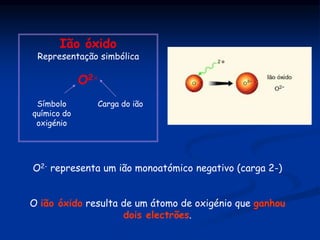
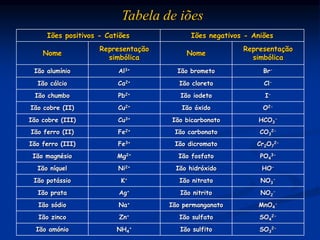
O documento discute substâncias iônicas e seus fenômenos elétricos. Explica como materiais adquirem cargas elétricas através da fricção e descreve experimentos para demonstrar atração e repulsão. Também define iões, explica sua formação a partir de átomos e moléculas, e como representá-los simbolicamente. Por fim, discute fórmulas químicas de substâncias iônicas e sua condutibilidade elétrica em estado sólido e solução aquosa.