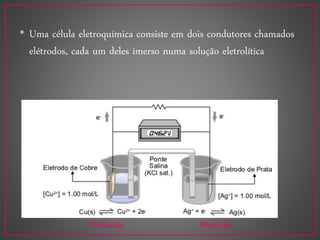
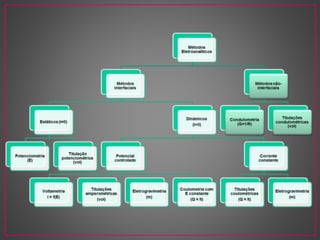
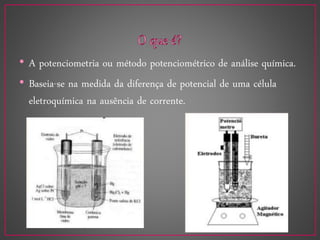
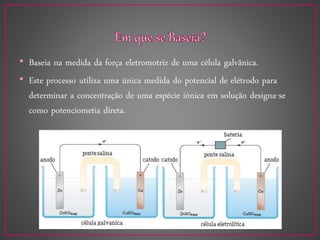
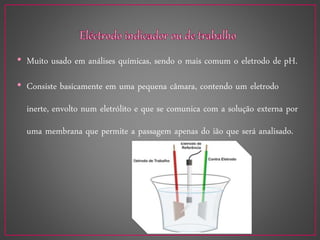
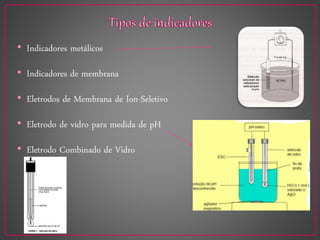
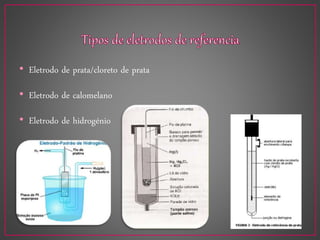
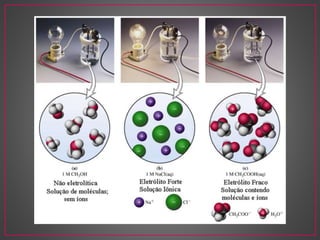
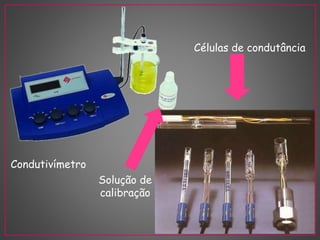
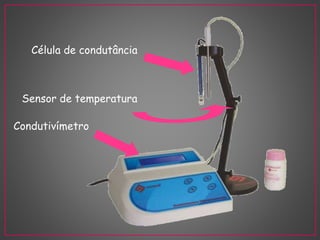
O documento discute métodos eletroanalíticos para análise química, incluindo potenciometria, condutometria e lei de Ohm. A potenciometria mede diferenças de potencial em células eletroquímicas para determinar concentrações iônicas, enquanto a condutometria mede condutância elétrica de soluções. Ambos fornecem análises quantitativas.