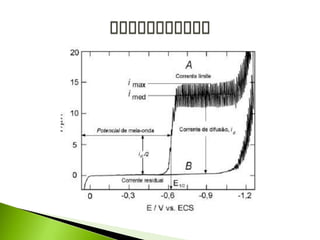
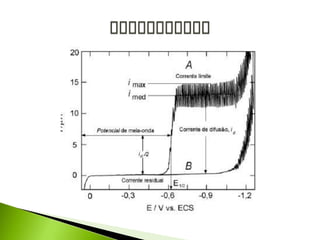
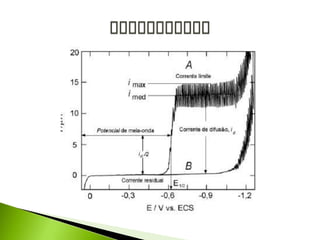
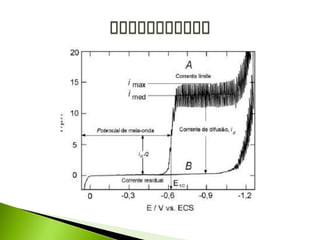
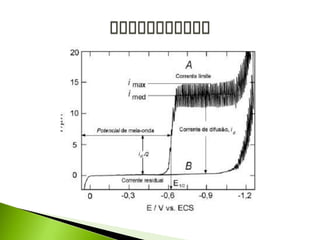
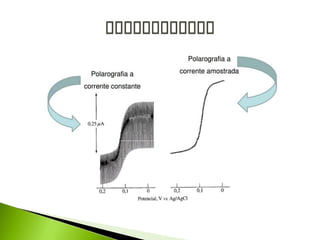
O documento descreve a técnica analítica de polarografia. Foi inventada em 1922 e envolve o uso de um eletrodo de mercúrio como catodo em uma solução diluída da amostra. A corrente medida durante a varredura lenta do potencial gera um polarograma, que fornece informações sobre as espécies eletroativas presentes.