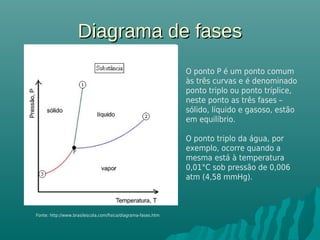
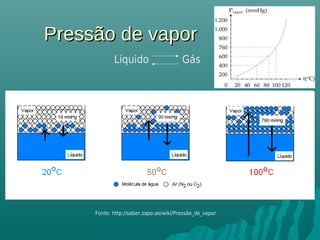
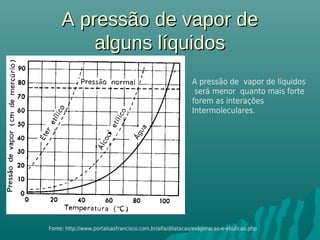
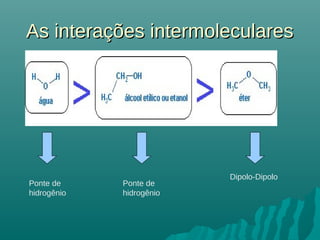
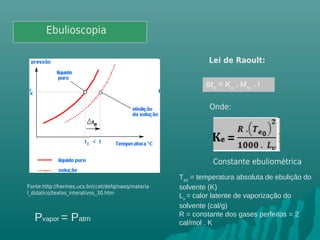
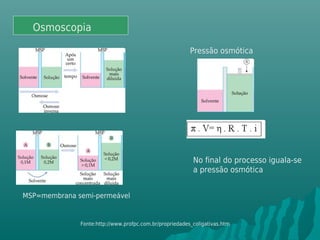
O documento discute propriedades coligativas, que são propriedades de soluções influenciadas pela quantidade de soluto, independente da natureza do soluto. Essas propriedades incluem aumento do ponto de ebulição, diminuição do ponto de congelamento, aumento da pressão osmótica e diminuição da pressão de vapor. Exemplos de aplicações práticas dessas propriedades em processos como resfriamento de radiadores de carros e preservação de alimentos através da adição de sal também são apresentados.