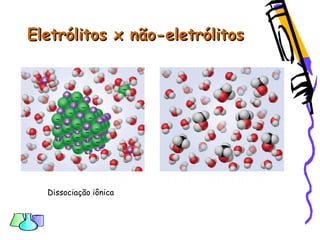
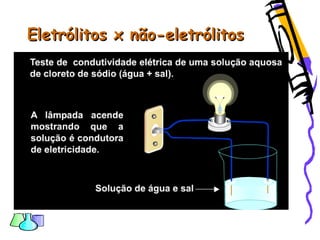
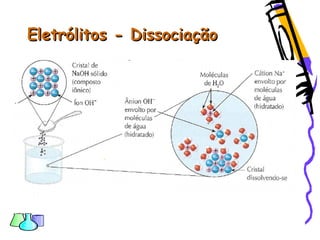
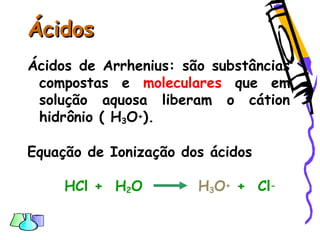
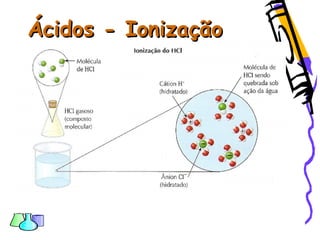
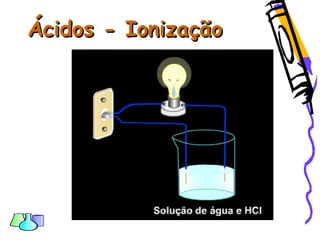
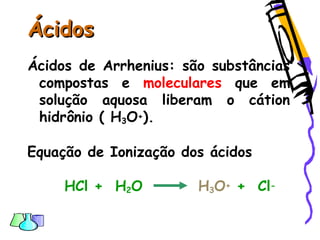
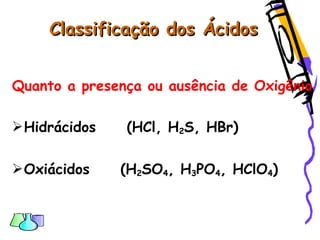
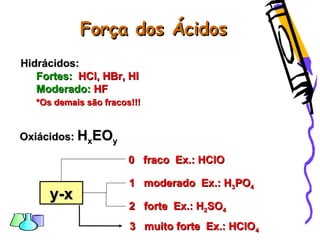
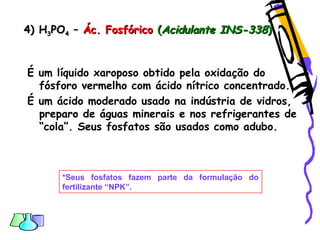
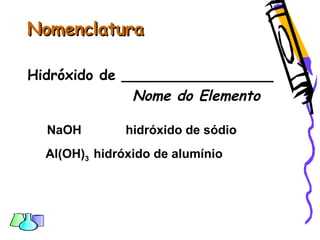
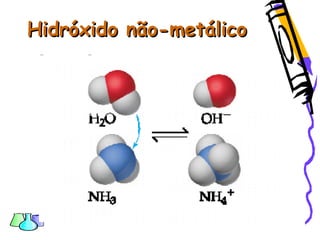
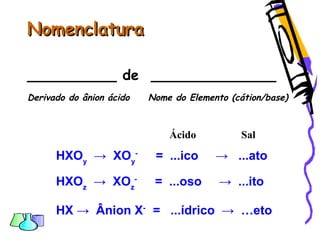
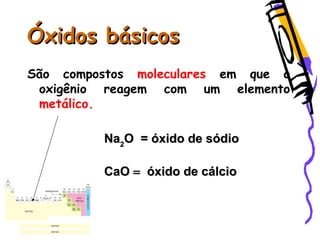
O documento discute as funções químicas inorgânicas de ácidos, bases, sais e óxidos. Define ácidos e bases segundo Arrhenius e descreve suas propriedades. Explica a ionização dos ácidos e classifica ácidos e bases de acordo com sua força e outros critérios. Apresenta exemplos importantes como os ácidos sulfúrico, clorídrico e nítrico.