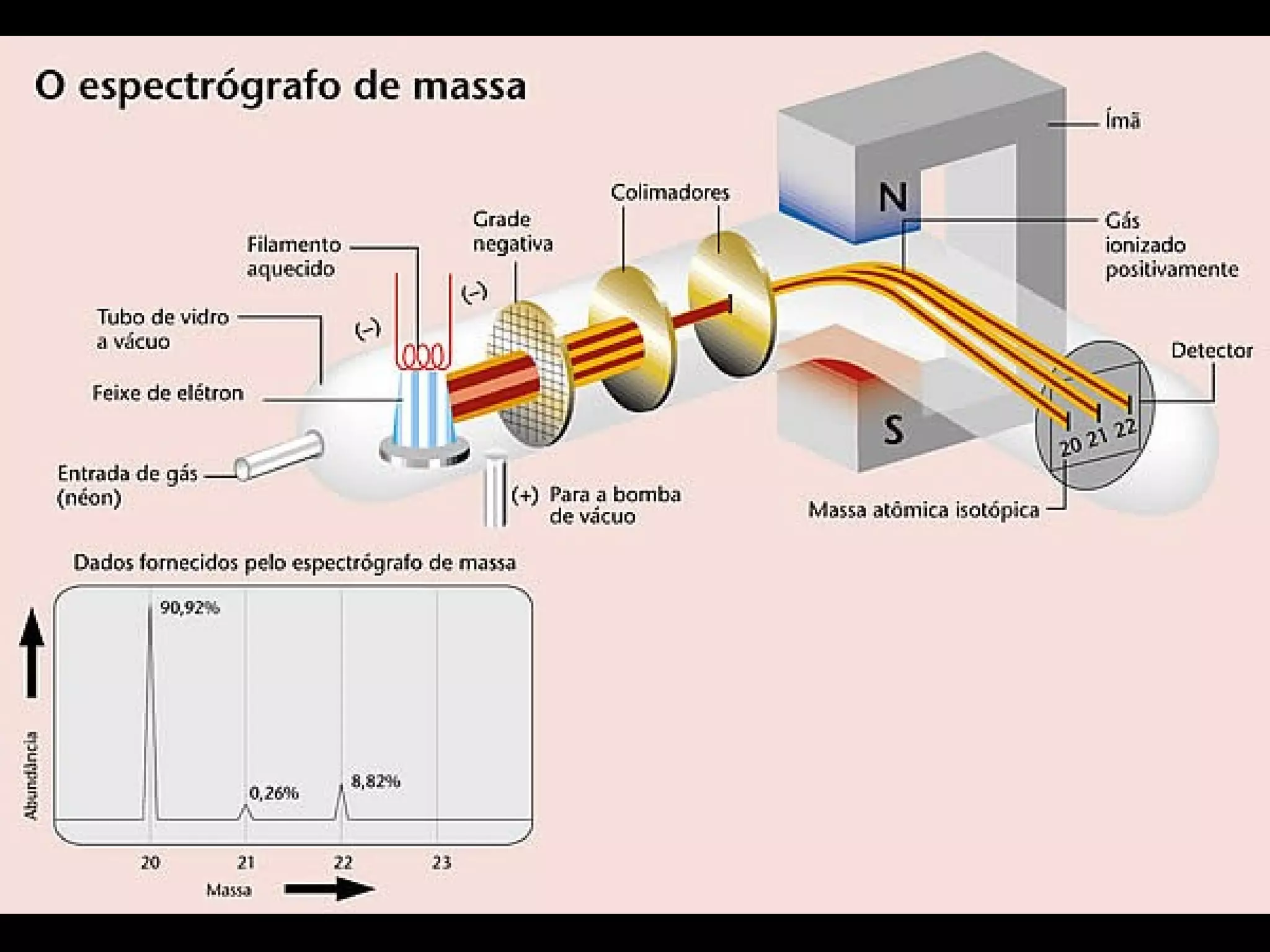
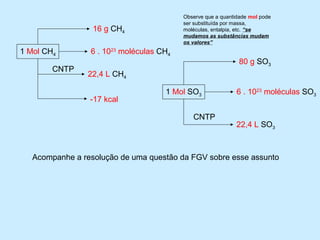
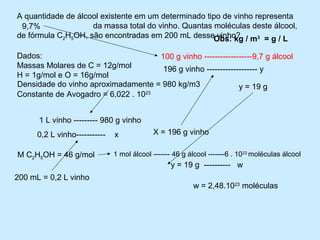
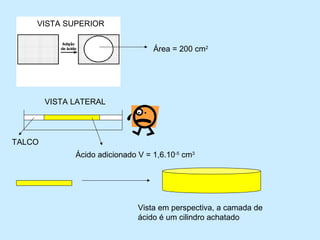
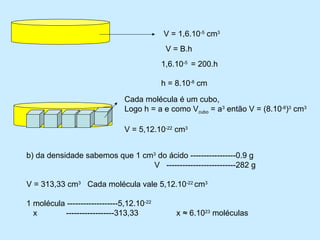
1) O documento descreve um experimento para estimar o tamanho de moléculas adicionando um ácido orgânico insolúvel em água sobre uma superfície de água. Isso forma um círculo de moléculas organizadas.
2) Ao medir a área do círculo e o volume de ácido adicionado, calcula-se que cada molécula ocupa um volume de 5,12x10^-22 cm3.
3) Dada a massa e densidade do ácido, calcula-se que 282g desse ácido contém aproxim