1) A teoria de Arrhenius define ácidos e bases em termos de íons liberados em solução aquosa, sendo ácidos substâncias que liberam H+ e bases substâncias que liberam OH-.
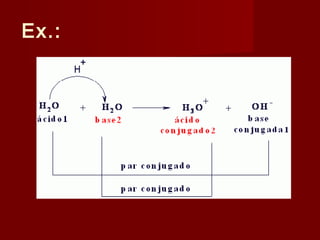
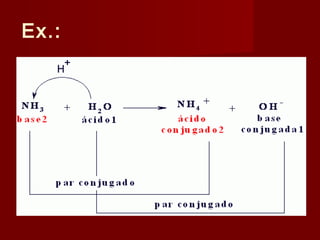
2) A teoria de Brønsted-Lowry define ácidos e bases em termos de doação e aceitação de prótons, sendo ácidos espécies doadoras de prótons e bases espécies aceitadoras de prótons.
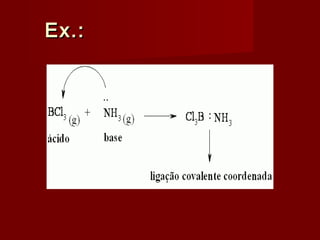
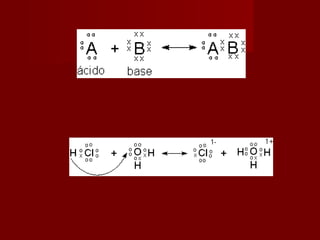
3) A teoria de Lewis define ácidos e bases em termos de doação e aceitação de pares de el


![Arrhenius:Teoria da
Dissociação Eletrolítica
Ácidos : são substâncias que contêm
hidrogênio e produzem o íon H + [ H3O+ ] (íon
hidrônio) como único cátion, quando em
solução aquosa.
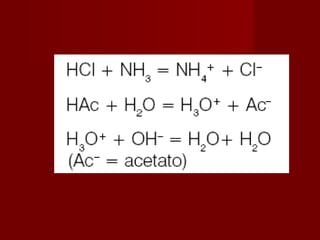
Ex.: HCl + H 2 O H 3 O + + Cl -
HNO 3 + H 2 O H 3 O + + NO 3 -](https://image.slidesharecdn.com/269-130327185815-phpapp02/85/269-3-320.jpg)