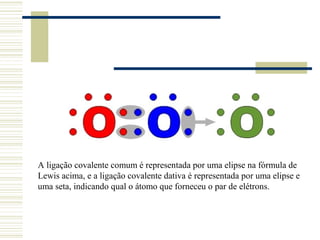
O documento discute as teorias sobre ligação covalente, incluindo a regra do octeto de Lewis e exceções a ela. A ligação covalente dativa é explicada onde um átomo fornece elétrons para completar o octeto de outro átomo, ilustrado pelo exemplo da molécula de ozônio O3.