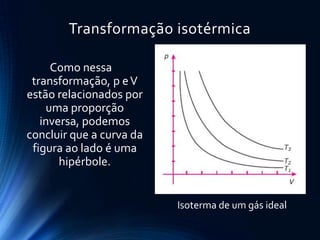
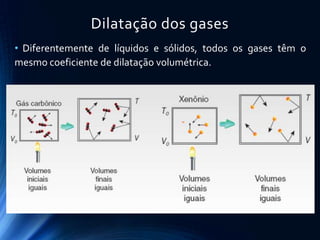
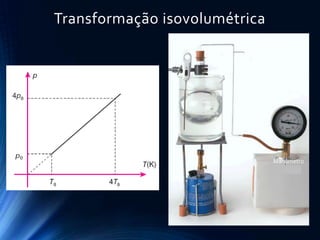
O documento discute o comportamento dos gases. Ele explica as leis de Boyle, Charles e Gay-Lussac, que descrevem como a pressão, volume e temperatura de um gás ideal se relacionam durante transformações isotérmicas, isobáricas e isovolumétricas. Ele também apresenta a equação geral dos gases ideais que relaciona essas variáveis de estado.