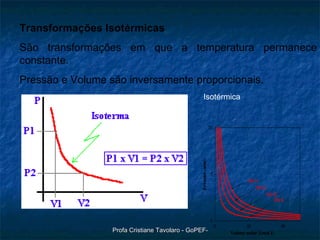
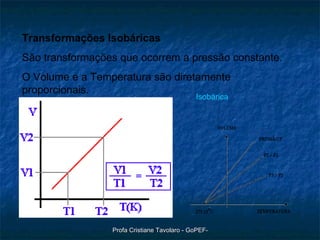
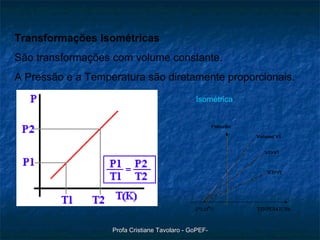
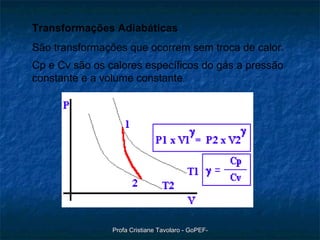
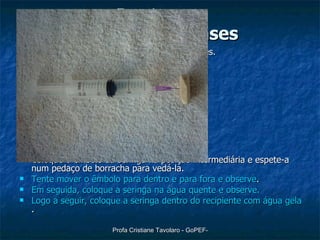
O documento discute o modelo do gás ideal, as variáveis macroscópicas que caracterizam o estado de um gás, as quatro transformações básicas de gases (isotérmica, isobárica, isométrica e adiabática) e a lei geral dos gases perfeitos de Clapeyron (PV=nRT). Também descreve um experimento para observar o comportamento dos gases.