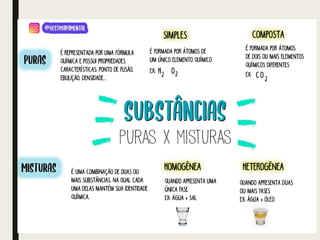
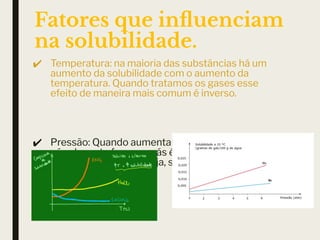
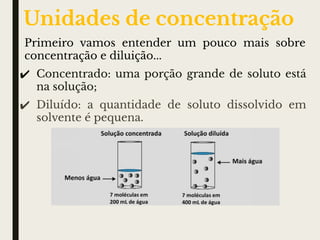
O documento discute conceitos sobre soluções, incluindo o conceito de solução, os componentes de uma solução (soluto e solvente), classificações de soluções (iônica e molecular), solubilidade, fatores que influenciam na solubilidade como temperatura e pressão, concentração de soluções em massa e volume, e cálculos de diluição de soluções.