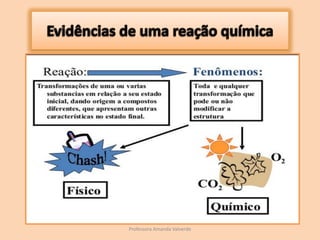
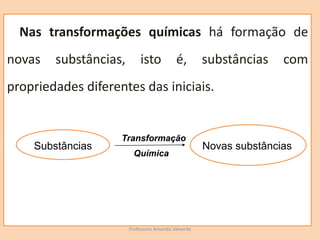
O documento discute transformações físicas e químicas, explicando que transformações físicas mantêm as mesmas substâncias com propriedades alteradas, enquanto transformações químicas formam novas substâncias. Também resume os tipos de reações químicas, incluindo síntese, análise, deslocamento e permuta.