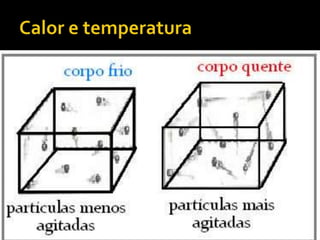
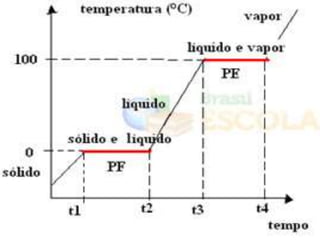
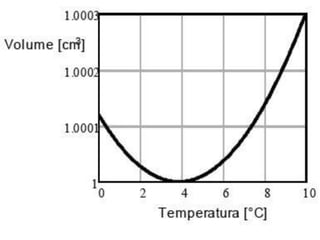
O documento discute os conceitos de temperatura, calor e transferência de calor. Explica que temperatura é uma medida da agitação térmica e que quanto maior a temperatura, maior a energia cinética das partículas. Também aborda os tipos de transferência de calor, como condução, convecção e irradiação.