Este documento resume os principais conceitos da cinética química, incluindo: 1) a definição de velocidade de reação e seus fatores que influenciam, como temperatura e concentração dos reagentes; 2) a teoria das colisões e do complexo ativado; 3) os tipos de catalisadores e como eles afetam a energia de ativação.


![ Velocidade média em
função das substâncias
o Velocidade de formação
vm =
Δ풒풖풂풏풕풊풅풂풅풆
Δ풕풆풎풑풐
aA + bB cC + dD
o Velocidade de consumo
vm=
풒풖풂풏풕풊풅풂풅풆 풅풆 풓풆풂품풆풏풕풆 풄풐풏풔풖풎풊풅풐
풊풏풕풆풓풗풂풍풐 풅풆 풕풆풎풑풐
vm =
Δ풏 풅풐 풓풆풂품풆풏풕풆
Δ풕
ou
vm =
Δ[풓풆풂품풆풏풕풆]
Δ풕
vm =
풒풖풂풏풕풊풅풂풅풆 풅풆 풑풓풐풅풖풕풐 풇풐풓풎풂풅풐
풊풏풕풆풓풗풂풍풐 풅풆 풕풆풎풑풐
Vm =
Δ풏 풅풐 풑풓풐풅풖풕풐
Δ풕
ou
Vm =
Δ 풑풓풐풅풖풕풐
Δ풕
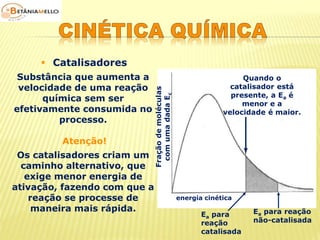
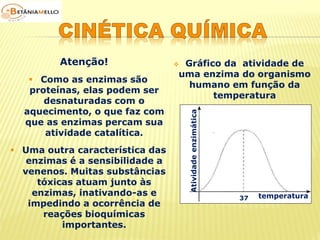
É bom saber!
O símbolo [ ] é usado em
físico-química para
representar a concentração
em quantidade de matéria.](https://image.slidesharecdn.com/cinticaqumica-141002231720-phpapp02/85/Cinetica-quimica-3-320.jpg)
![Exemplo:
2 NH3(g) N2(g) + 3 H2(g)
[NH3] 8,0 4,0 2,0 1,0
Tempo (h) 0 1,0 2,0 3,0
2 NH3(g) N2(g) + 3 H2(g)
Proporção 2 : 1 : 3
estequiométrica
De 0h a 1h 4mol/L 2mol/L 6mol/L
De 1h a 2h 2mol/L 1mol/L 3mol/L
De 2h a 3h 1mol/L 0,5mol/L 1,5mol/L
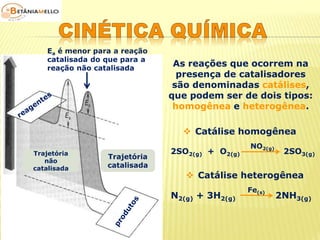
A velocidade dos participantes de uma reação é
proporcional aos seus respectivos coeficientes na
equação química balanceada.](https://image.slidesharecdn.com/cinticaqumica-141002231720-phpapp02/85/Cinetica-quimica-4-320.jpg)
![ Velocidade média da reação
É o módulo da velocidade de consumo de um dos
reagentes, ou da velocidade de formação de um dos
produtos dividido pelo respectivo coeficiente da
substância na equação da reação corretamente
balanceada.
aA + bB cC + dD
vm reação = |
Δ 푨
풂 . Δ풕
| = |
Δ[푩]
풃 . Δ풕
| = |
Δ[푪]
풄 . Δ풕
| = |
Δ[푫]
풅 . Δ풕
|
É bom saber!
Essa definição foi convencionada pela IUPAC e permite
calcular a velocidade média de uma reação sem especificar
a substância participante.](https://image.slidesharecdn.com/cinticaqumica-141002231720-phpapp02/85/Cinetica-quimica-5-320.jpg)

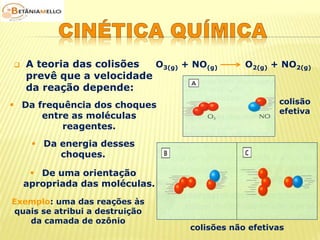
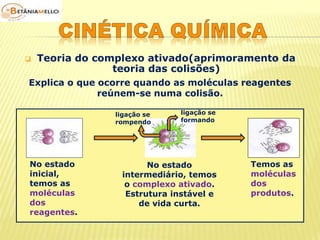
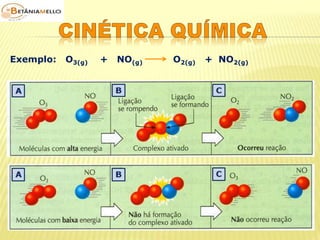


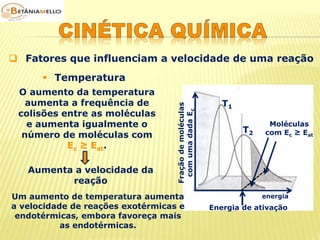

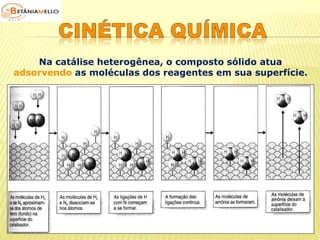





![ Concentração dos
reagentes
Lei da ação das massas
(Guldberg – Waage)
É a quantidade de partícula
de reagente existente por
unidade de volume.
Aumento da concentração
dos reagentes maior
número de moléculas por
unidade de volume
maior probabilidade de
colisões efetivas maior
velocidade da reação.
a X + b Y produtos
v ∝ [X]m . [Y]n
v = k . [X]m . [Y]n
Onde:
v = velocidade da reação
k = constante de velocidade ou
constante cinética
(característica da reação e da
temperatura)
m e n = expoentes determinados
experimentalmente](https://image.slidesharecdn.com/cinticaqumica-141002231720-phpapp02/85/Cinetica-quimica-23-320.jpg)
![ A velocidade é
diretamente proporcional
à uma constante (k) que
depende da temperatura
e da energia de ativação
da reação.
Consideremos uma reação
genérica que ocorra em uma
etapa (reação elementar)
a X + b Y produtos
Quando uma reação se
desenvolve em uma
única etapa, dizemos que
a reação é elementar.
Os expoentes na lei da
velocidade, para um
processo elementar, são
iguais aos coeficientes
dos reagentes na equação
química balanceada.
v = k . [X]a . [Y]b
Quando uma reação se
desenvolve em duas ou
mais etapas distintas, a
velocidade da reação
depende apenas da etapa
mais lenta.
A etapa lenta é a etapa
determinante da velocidade da
reação.](https://image.slidesharecdn.com/cinticaqumica-141002231720-phpapp02/85/Cinetica-quimica-24-320.jpg)
![NO2(g) + CO(g) NO(g) + CO2(g)
Cada etapa de uma reação
que se processa em mais de
uma etapa é considerada
elementar.
Exemplo:
1ª etapa (lenta):
2 NO2(g) NO3(g) + NO(g)
2ª etapa (rápida):
NO3(g) + CO(g) NO2(g) + CO2(g)
NO2(g) + CO(g) NO(g) + CO2(g)
Reação global
Equação da velocidade
v = k . [NO2]2
Concentração de intermediário
energia
não figura na lei cinética.
Eat (1ª etapa)
Eat (2ª etapa)
caminho da reação
2NO2
NO3 + NO + CO
NO + CO2](https://image.slidesharecdn.com/cinticaqumica-141002231720-phpapp02/85/Cinetica-quimica-25-320.jpg)
![ Ordem de uma reação,
no total, é a soma das
ordens com relação a
cada um dos reagentes
na lei da velocidade.
Atenção!
2H2(g) + 2NO(g) N2(g) + 2H2O(g)
v = k [H2] [NO]2
Ordem da reação: 1 + 2 = 3
(3ª ordem)
Ordem da reação em relação
ao H2(g) = 1ª ordem
Ordem da reação em relação
ao NO(g) = 2ª ordem
Os expoentes numa lei da
velocidade são normalmente
todos números inteiros e
pequenos, porém expoentes
fracionários e negativos são
encontrados ocasionalmente.
Há ainda reações de ordem
zero. Essas reações têm
velocidade que são
independentes da
concentração de qualquer
reagente.](https://image.slidesharecdn.com/cinticaqumica-141002231720-phpapp02/85/Cinetica-quimica-26-320.jpg)


![ Reação de ordem zero
v = k . [R]0
[R]
tempo
A concentração do
reagente de uma reação
de ordem zero cai com
velocidade constante até
que ele se acabe
Velocidade da reação
tempo
A velocidade da reação é
independente da
concentração do reagente
e permanece constante
até que todo o reagente
tenha sido consumido.
t1/2 =
푹 풐
ퟐ풌](https://image.slidesharecdn.com/cinticaqumica-141002231720-phpapp02/85/Cinetica-quimica-29-320.jpg)
![ Reação de 1ª ordem
v = k . [R]1
[reagente]
tempo
Concentração molar do reagente
k1
tempo
k2
kpequeno
kgrande
(mais rápida)
t1/2 =
ℓ풏ퟐ
풌](https://image.slidesharecdn.com/cinticaqumica-141002231720-phpapp02/85/Cinetica-quimica-30-320.jpg)
