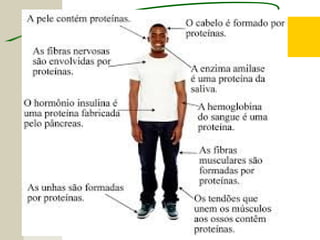
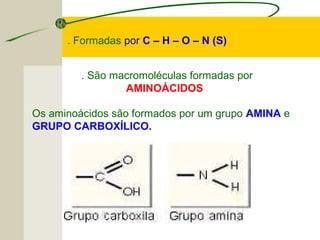
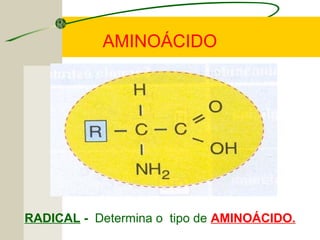
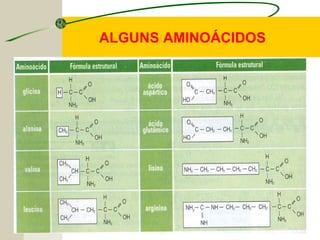
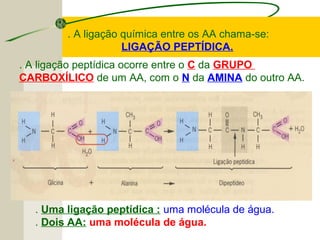
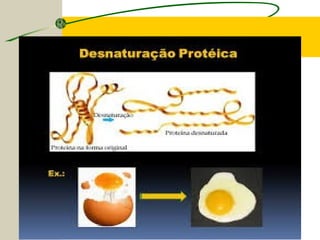
O documento discute as proteínas, seus componentes estruturais e funções. As proteínas são formadas por aminoácidos unidos por ligações peptídicas. Existem 20 tipos de aminoácidos, alguns essenciais e outros não essenciais. As proteínas podem ter funções estruturais, enzimáticas ou de transporte, dependendo de sua estrutura tridimensional que pode ser alterada por fatores como temperatura e pH.