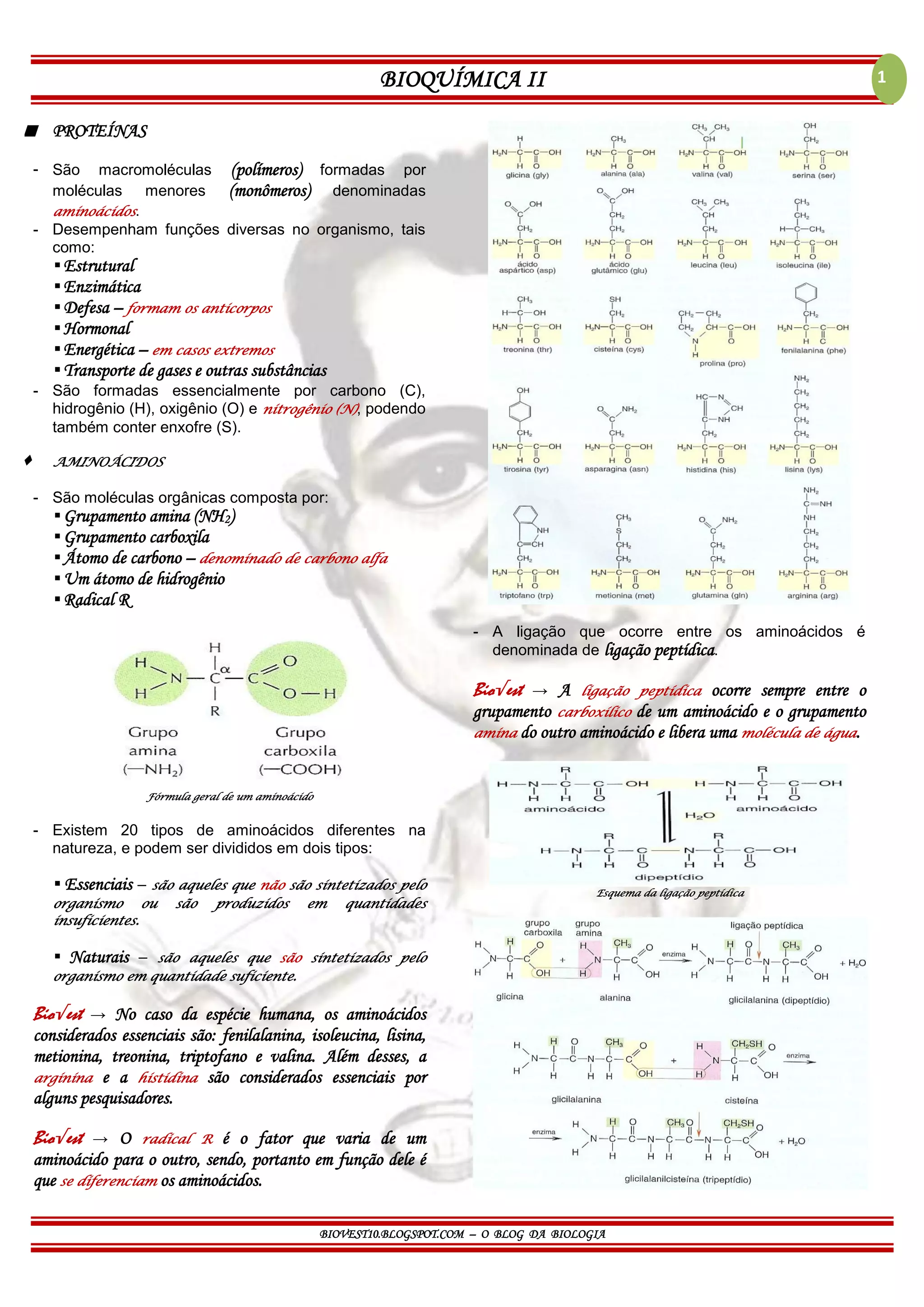
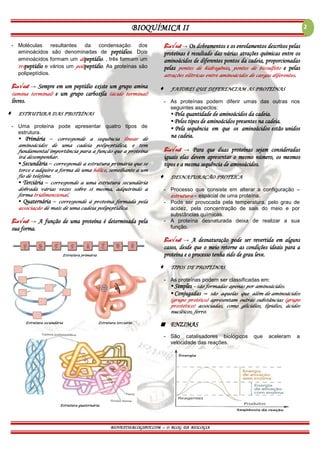
O documento discute as proteínas, aminoácidos, estrutura e função de proteínas e enzimas. Cobre tópicos como as quatro estruturas de proteínas (primária, secundária, terciária e quaternária), os 20 tipos de aminoácidos, a ligação peptídica, desnaturação proteica, enzimas como catalisadores biológicos, e anticorpos e vacinas.