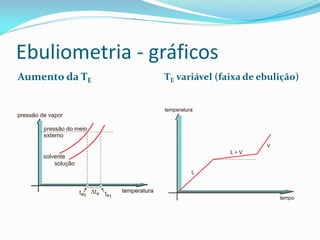
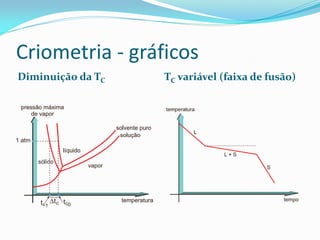
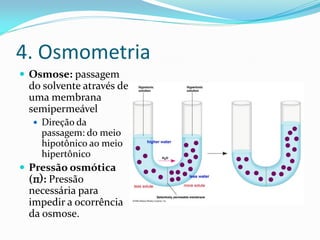
O documento discute as propriedades coligativas de soluções, que dependem do número de partículas dispersas. Essas propriedades incluem a baixa da pressão de vapor, elevação da temperatura de ebulição, baixa da temperatura de congelamento e pressão osmótica exercida. O documento também explica como calcular o número de partículas em diferentes tipos de soluções através de reações químicas.