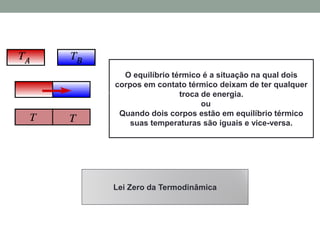
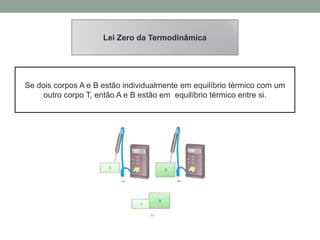
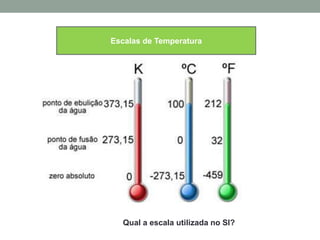
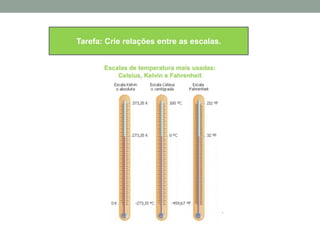
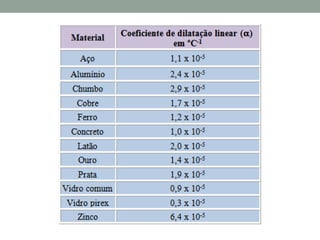
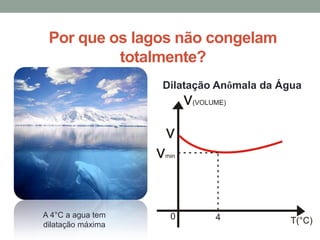
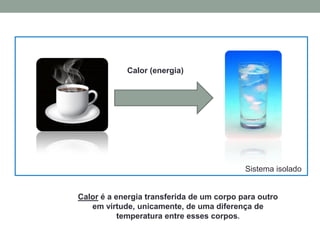
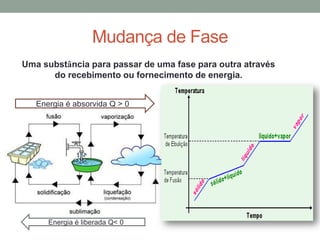
1) O documento discute os conceitos fundamentais da termodinâmica, incluindo temperatura, equilíbrio térmico, dilatação, calor, mudança de fase e mecanismos de transferência de calor.
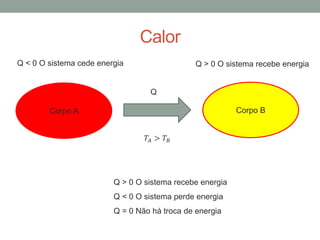
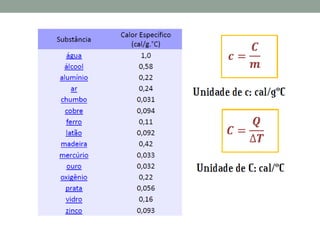
2) São apresentadas as leis da termodinâmica, além de conceitos como capacidade térmica, calor específico e calor latente.
3) Exemplos numéricos são fornecidos para exemplificar esses conceitos.