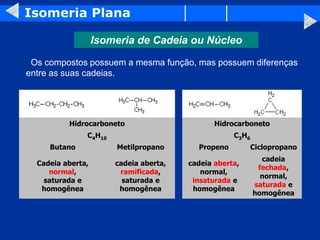
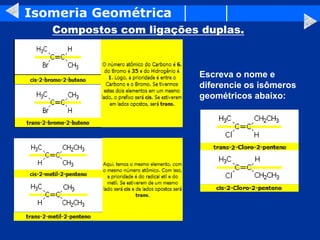
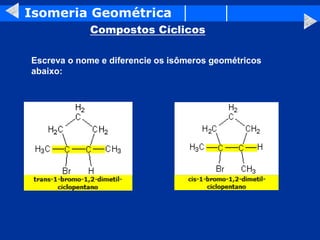
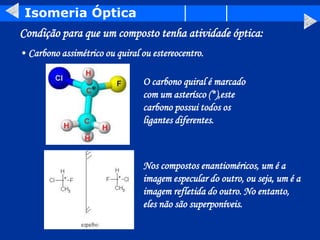
O documento discute os conceitos de isomeria, incluindo isomeria plana e estereoisomeria. A isomeria plana inclui isomeria de função, cadeia, posição, metameria e tautomeria. A estereoisomeria inclui isomeria geométrica e óptica. A isomeria geométrica ocorre quando compostos têm estruturas tridimensionais diferentes, enquanto a isomeria óptica ocorre quando compostos têm carbonos assimétricos e são imagens especulares um do outro.