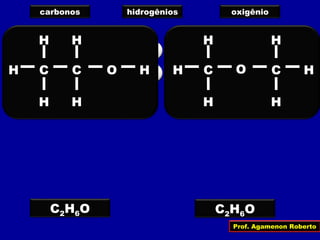
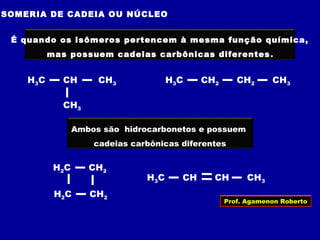
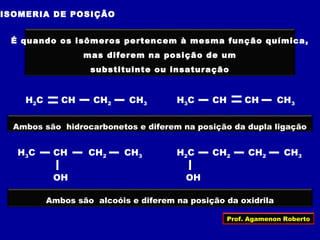
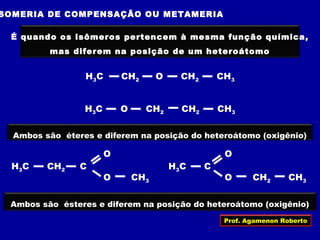
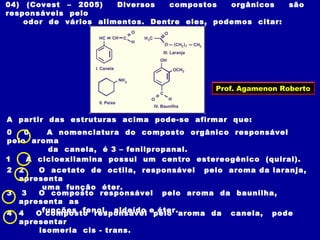
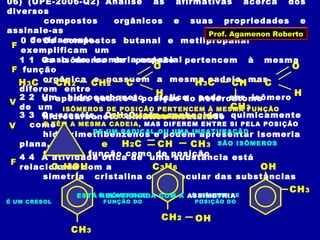
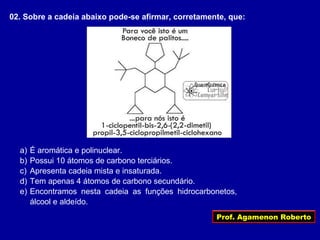
O documento descreve os conceitos de isomeria, incluindo:
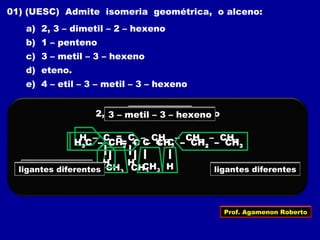
1) Isômeros são compostos com a mesma fórmula molecular mas estruturas diferentes;
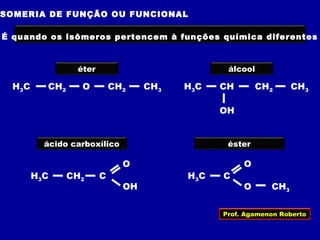
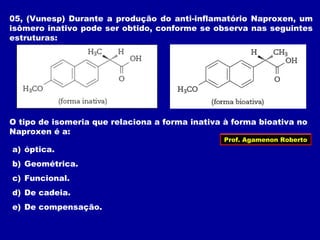
2) Existem diferentes tipos de isomeria como de cadeia, posição, compensação e função;
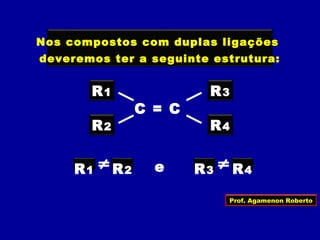
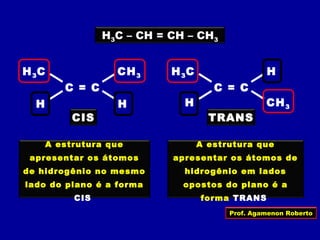
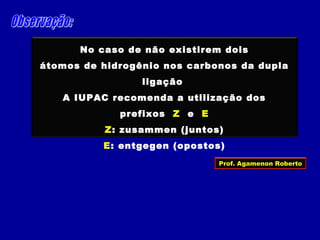
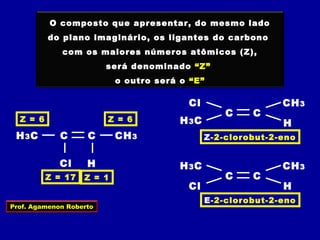
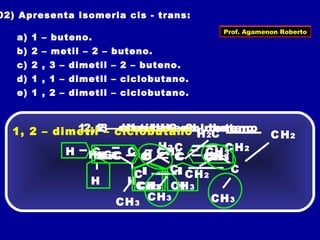
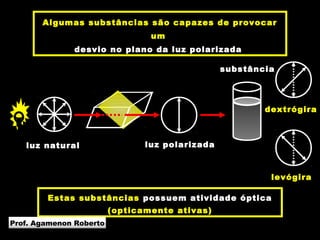
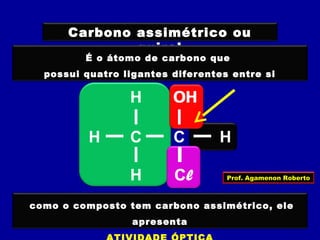
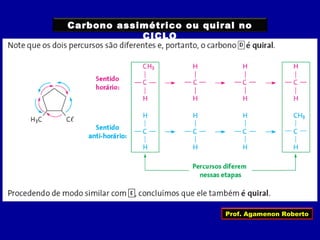
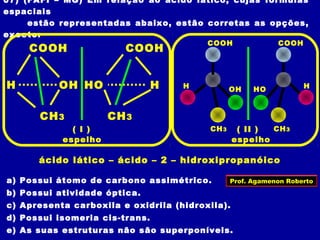
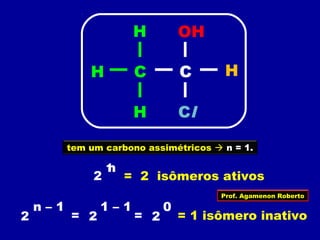
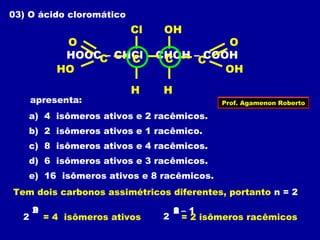
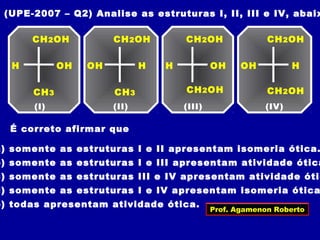
3) A isomeria espacial inclui a geométrica (cis-trans) e óptica, esta relacionada a compostos com carbono assimétrico.