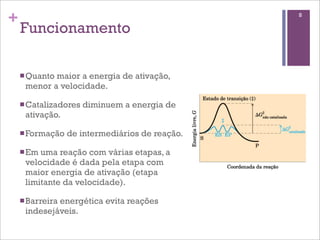
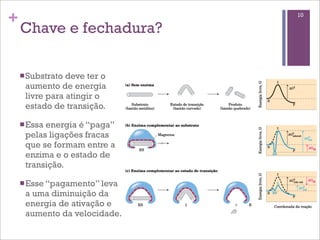
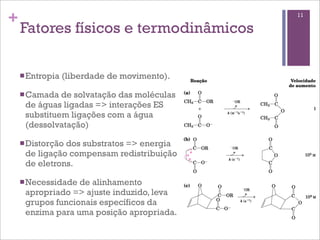
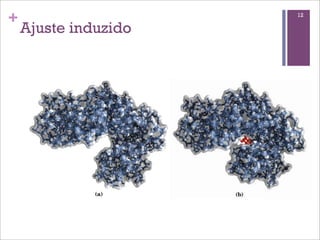
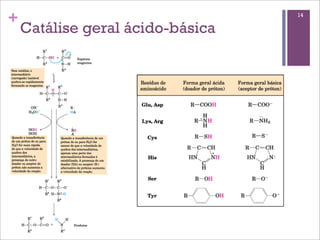
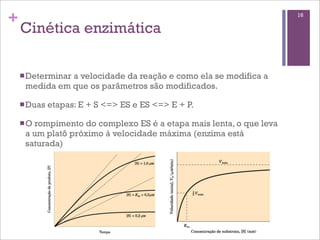
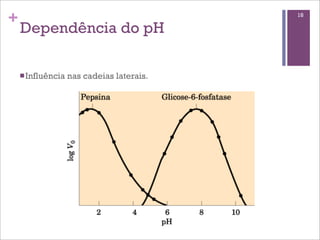
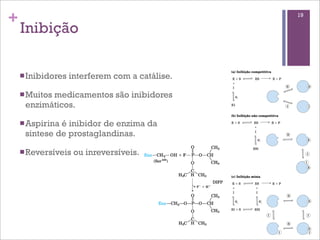
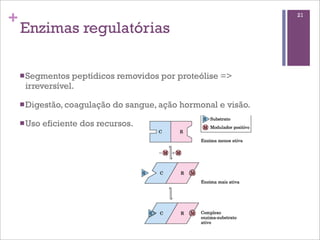
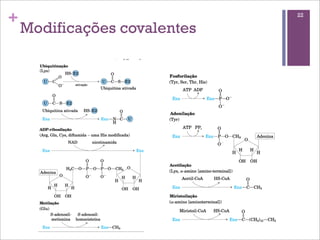
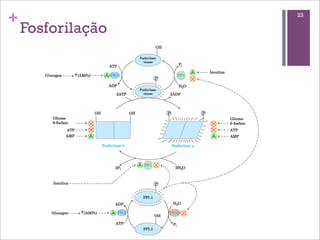
Este documento resume as principais características e funções das enzimas. Discute a história do estudo das enzimas, sua estrutura e composição proteica, mecanismos de ação, cinética enzimática, fatores que afetam a velocidade de reação, tipos de inibição e mecanismos de regulação enzimática, incluindo modificações covalentes como a fosforilação.