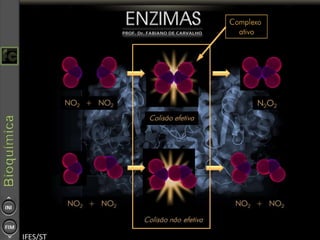
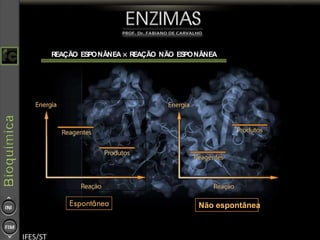
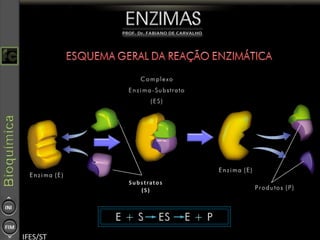
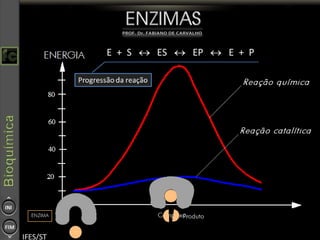
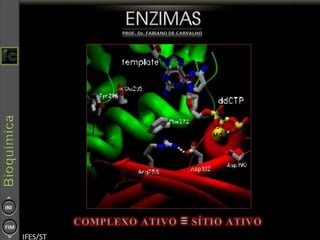
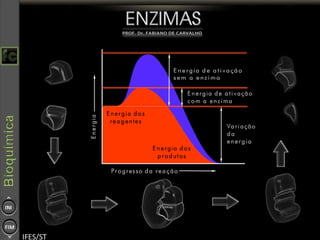
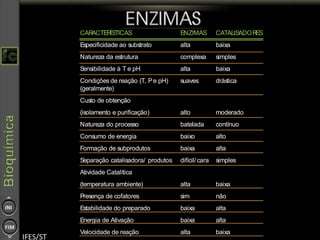
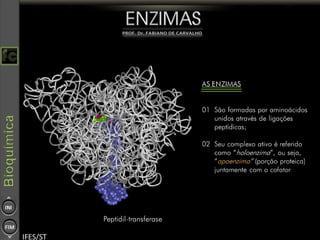
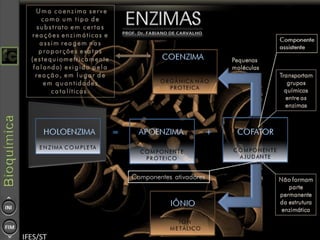
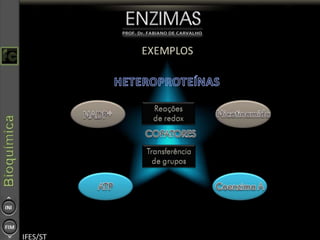
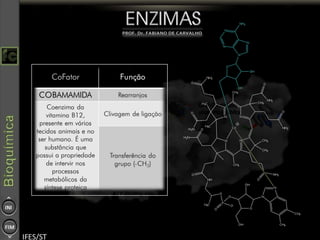
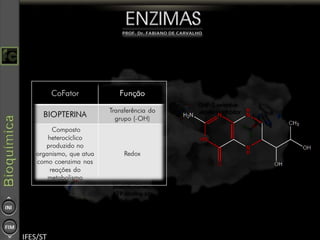
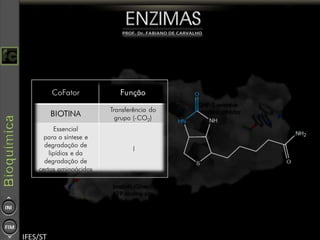
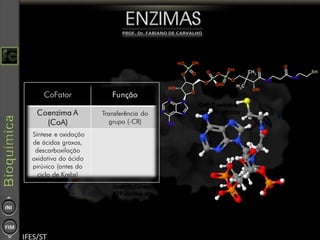
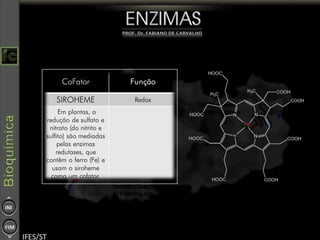
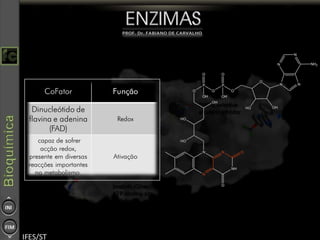
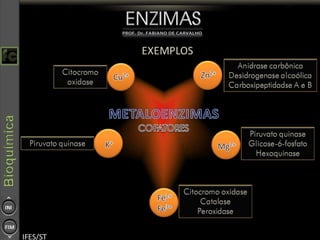
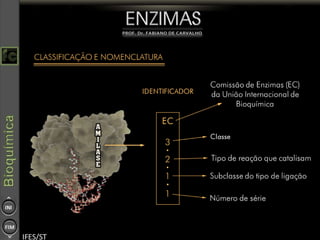
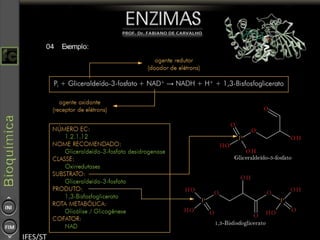
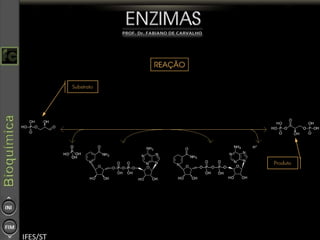
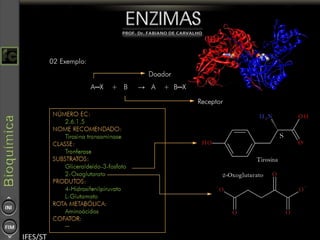
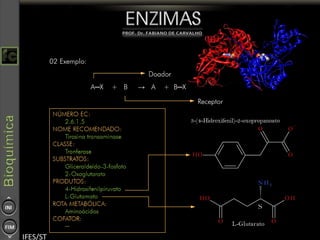
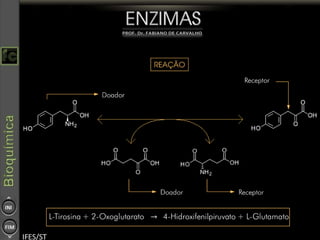
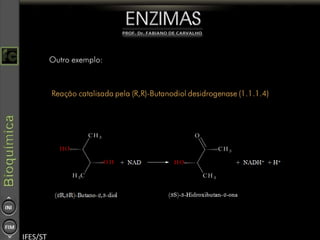
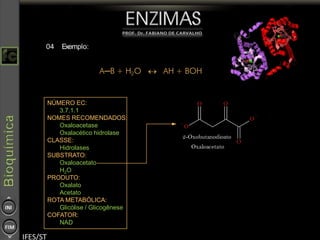
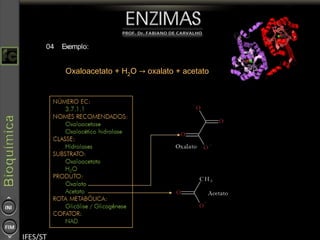
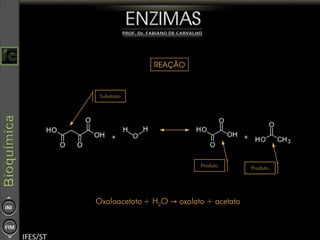
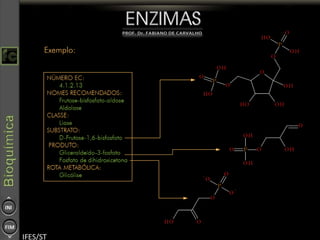
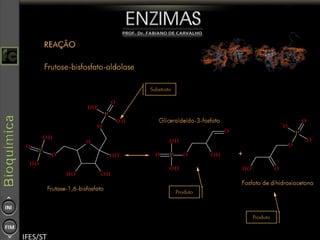
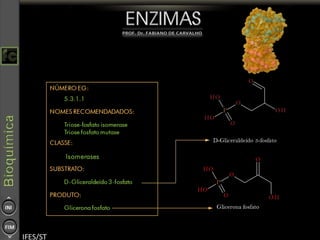
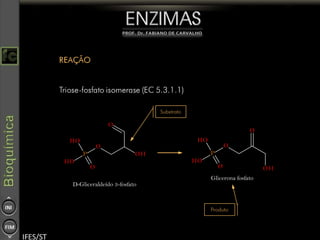
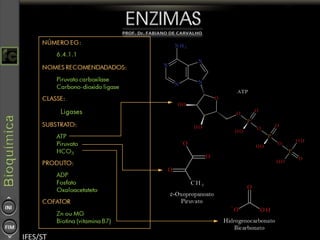
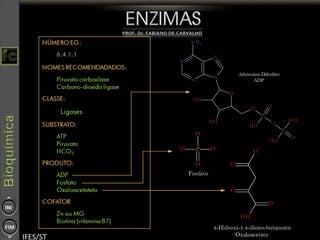
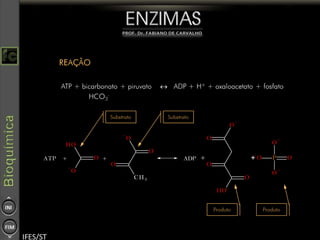
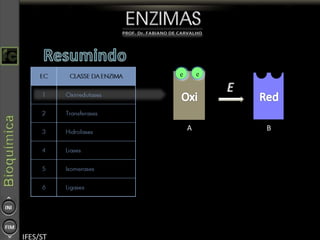
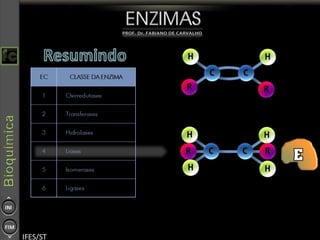
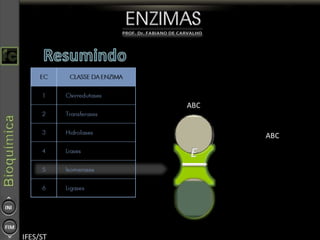
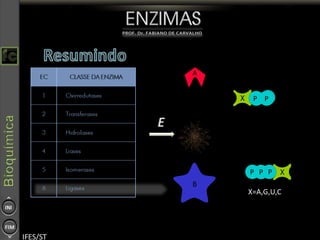
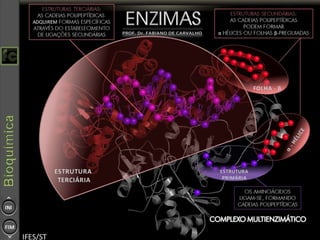
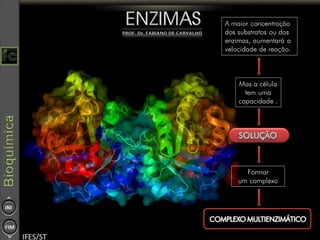
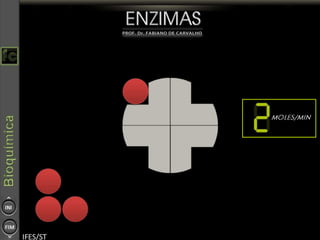
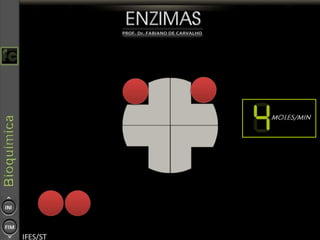
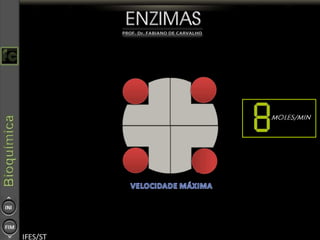
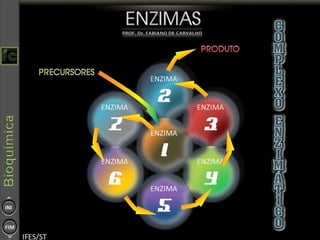
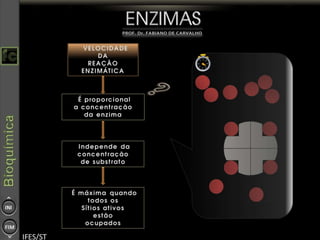
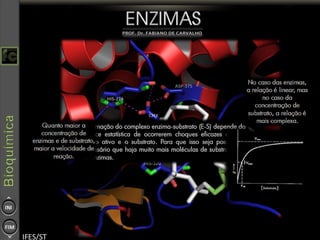
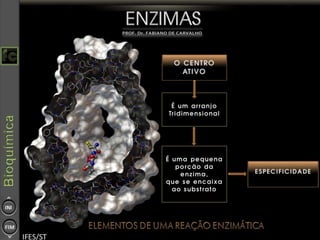
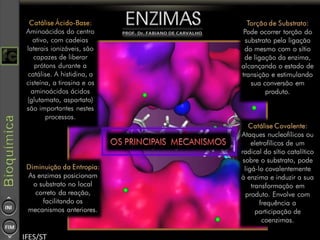
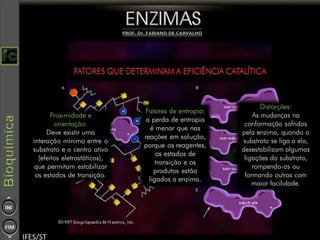
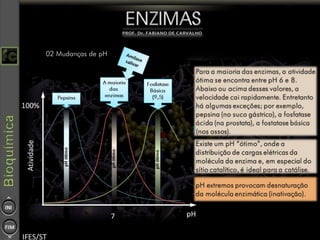
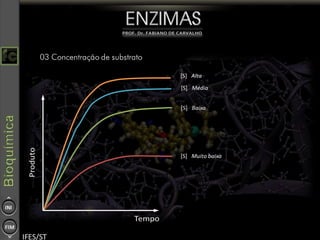
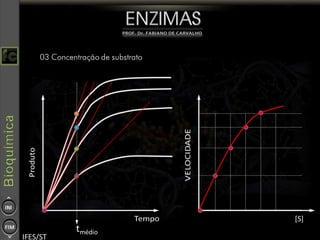
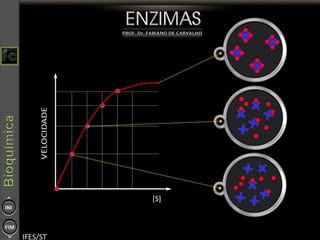
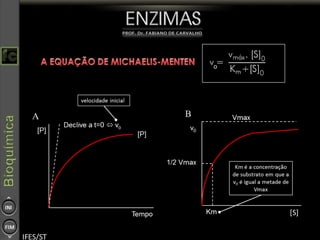
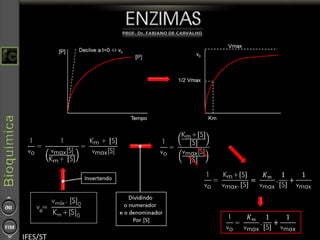
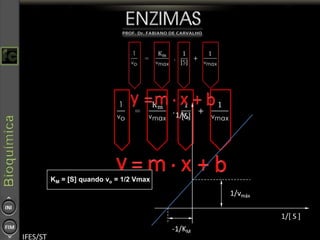
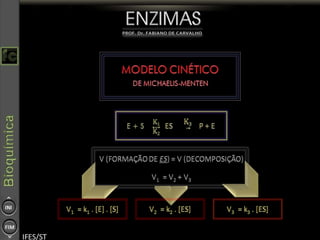
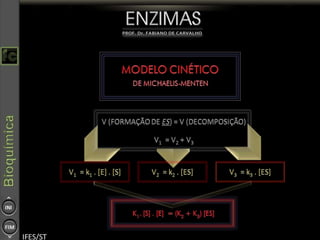
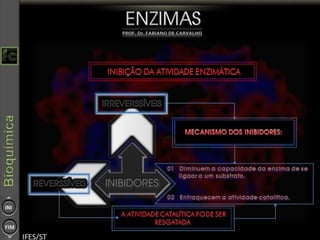
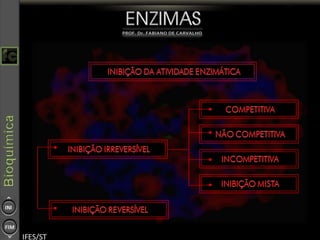
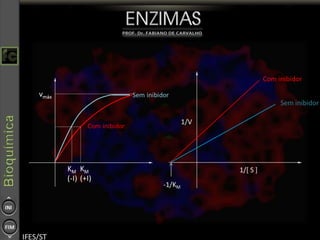
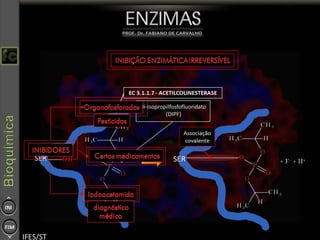
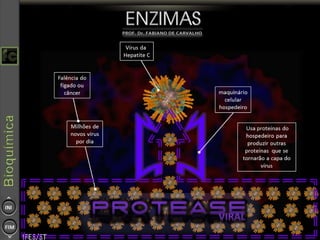
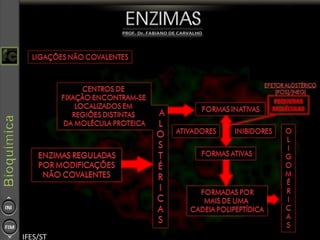
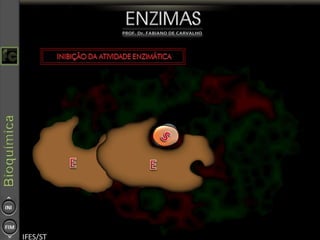
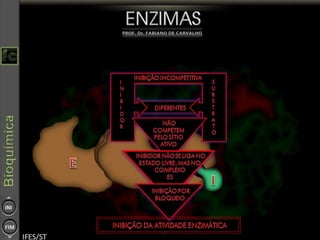
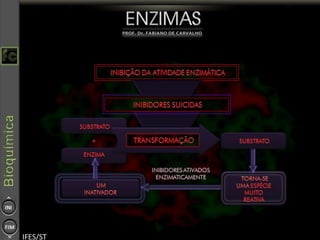
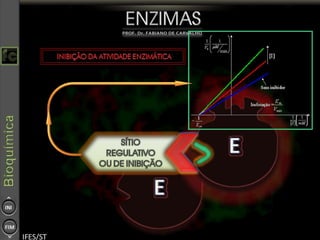
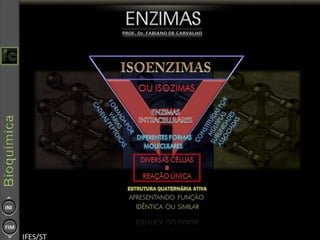
O documento descreve as propriedades e funções das enzimas, incluindo que elas atuam como catalisadores de reações metabólicas, diminuindo a energia de ativação necessária sem serem modificadas, e que existem diferentes tipos de enzimas classificadas de acordo com a reação catalisada.