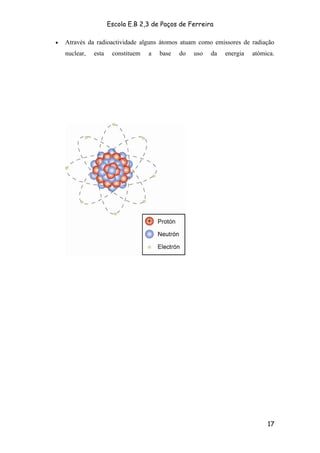
O documento descreve a evolução do modelo atômico ao longo da história, começando pelos filósofos gregos antigos como Demócrito que postularam a existência de átomos. Posteriormente, cientistas como Dalton, Thomson, Rutherford e Bohr desenvolveram modelos atômicos mais detalhados com base em novas evidências experimentais. O modelo atômico atual é baseado na mecânica quântica e vê os elétrons como probabilidade de ocupação de orbitais ao redor do núcleo.