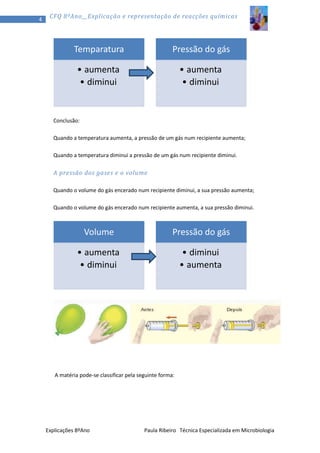
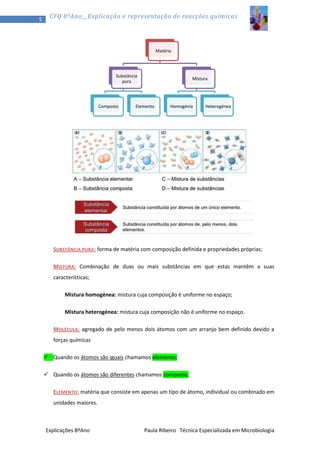
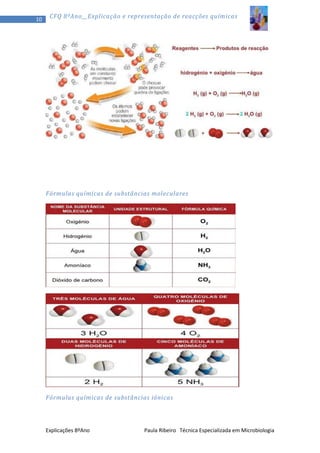
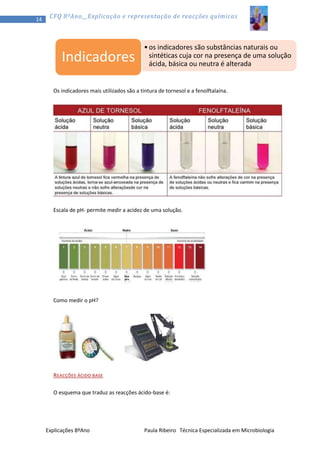
1) O documento discute a teoria corpuscular da matéria, explicando que toda a matéria é constituída por partículas chamadas átomos. 2) Aborda os três estados físicos da matéria - sólido, líquido e gasoso - e como os átomos se comportam em cada um. 3) Explica conceitos como pressão, temperatura e volume em relação aos gases.