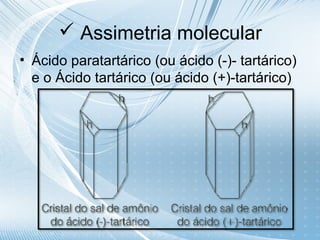
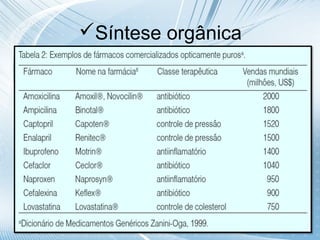
O documento discute quiralidade em fármacos, definindo quiralidade como a propriedade geométrica onde um objeto não pode ser sobreposto à sua imagem especular. Explica que alguns fármacos são quirais e que a orientação espacial dos átomos afeta os efeitos biológicos, requerendo síntese assimétrica para controlar a quiralidade.