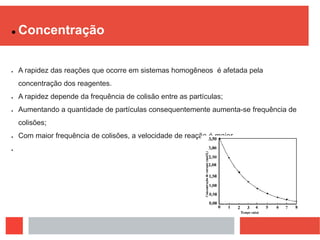
O documento discute os fatores que influenciam a velocidade de reações químicas de acordo com a teoria das colisões. A velocidade depende da frequência e eficácia das colisões entre as partículas de reagentes. Os principais fatores que afetam a velocidade são a superfície de contato, a temperatura, a concentração, a pressão e a luz, uma vez que esses fatores alteram a frequência e a energia das colisões.



![Cálculo da velocidade de reação
Cálculo: Δ[x]/Δt
Exemplo:
2N
2
O
5(g)
4NO
2(g)
+ O
2(g)
Δ [N
2
O
5
] = |2,08 – 2,33| = 0,25 mol/L
Δt = 184 – 0 = 184 min
Velocidade de reação = Δ [N
2
O
5
] / Δt
Velocidade de reação = 0,25 / 184
Velocidade de reação = 0,00136 mol/L/min ou 1,36.10
-3
mol/L/min
Medida Tempo (min) [N
2
O
5
] (mol/L)
1 0 2,33
2 184 2,08](https://image.slidesharecdn.com/cinetica-170811111647/85/Cinetica-4-320.jpg)